-
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。
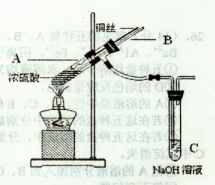
①装置A中发生反应的化学方程式为________;
②上图装置中导管B的作用你认为可能是(写出一种)________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过________、________、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致________。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式________。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是________(已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
-
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
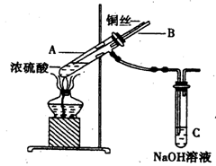
(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
-
SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
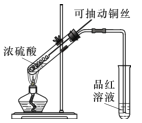
(1)甲同学按照教材实验要求设计如图所示装置制取SO2
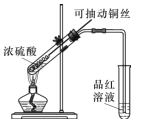
①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
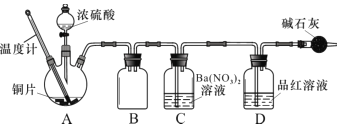
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):
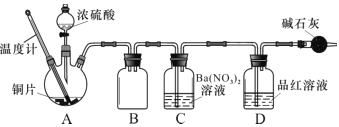
实验记录 A 中现象如下:
| 序号 | 反应温度/℃ | 实验现象 |
| 1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
| 2 | 158 | 黑色固体产生的同时,有气体生成 |
| 3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
| 4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
| 5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。
-
SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
(1)甲同学按照教材实验要求设计如图所示装置制取SO2
①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):
实验记录 A 中现象如下:
| 序号 | 反应温度/℃ | 实验现象 |
| 1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
| 2 | 158 | 黑色固体产生的同时,有气体生成 |
| 3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
| 4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
| 5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。
-
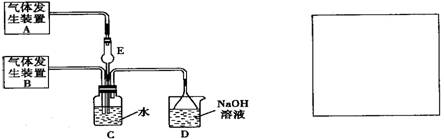
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如图所示的实验装置.
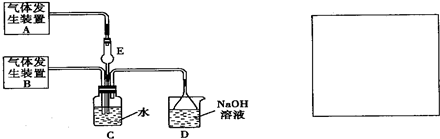
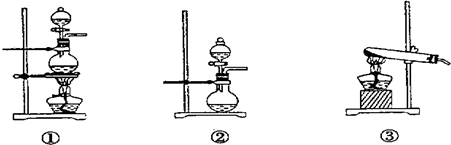
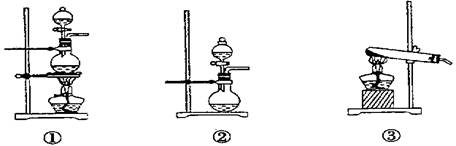
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2.已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是______;发生装置B应选择以下三种装置中的______(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式______.
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在______装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂.
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)⇌SO2Cl2(l)△H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同.
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是______(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
-
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
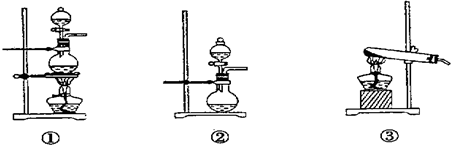
________;发生装置B应选择以下三种装置中的________(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式________。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在________装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)  SO2Cl2(l) △H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l) △H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是________(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是________。
-
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如图所示的实验装置.
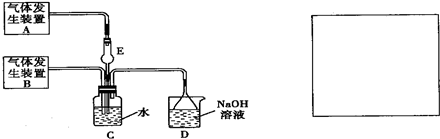
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2.已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是______;发生装置B应选择以下三种装置中的______(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式______.
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在______装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂.
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)⇌SO2Cl2(l)△H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同.
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是______(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
-
为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了图1所示的实验装置。
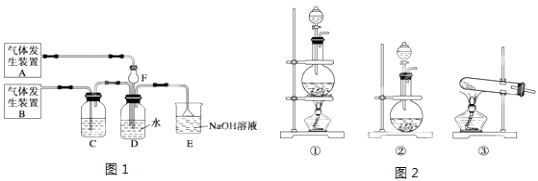
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。请写出制取Cl2的离子方程式: 。
(2)在此实验中,F仪器的作用是:______________;发生装置B应选择图2三种装置中的___________(填序号)。
(3)D装置中主要反应的离子方程式为 。
(4)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰酸钾溶液 ④品红溶液 ⑤溴水 ⑥稀硝酸
A.若Cl2过量:取适量D中溶液滴加至盛有试剂的试管内,发生的现象是: ;(试剂可以多选,请填试剂的序号,下同)。
B.若SO2过量:取适量D中溶液滴加至盛有试剂的试管内,发生的现象是: 。
-
(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
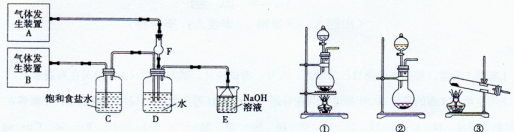
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;气体发生装置B应选择①、②、③三种装置中的________(选填序号)。
(2)D装置中主要反应的离子方程式为:________。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有________(试剂名称,下同)的试管中,再加入产生的现象是,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有________的试管内,产生的现象是________。
-
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如下图所示:
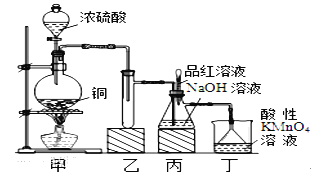
(1)装置甲中发生反应的化学方程式是________________,装置乙的作用是___________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为___________________。
(3)SO2气体有漂白性、还原性和氧化性。将SO2通入溴水中,SO2表现的是__________性,化学反应方程式为_________________________________。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 _____________,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1 mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量1 mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | (空) |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加__________________。 | 若品红褪色(或有气泡),则说明含有Na2SO3。 |
| 步骤3: 用试管取少量A,向其中加入过量___________。 | 若生成白色沉淀,则说明有NaHSO3生成 |














