-
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
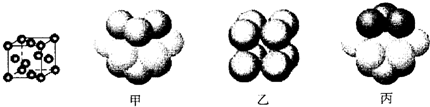
-
已知 T、X、Y、Z 是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p 电子数 |
| X | 元素的原子半径是第三周期主族元素中最大的 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出这四种元素能形成的常见配体______________;(写两种)
(2)T、X、Y 三种元素的电负性由大到小的顺序(填元素符号)是_______第一电离能由大到小的顺序是__________;
(3)元素 Q 的原子序数是X与Z的原子序数之和。
①该元素基态原子的外围电子排布式为_____________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,Q的配位数为_______,其中Q与 Z 成键时中心原子采用的杂化方式是_______。
-
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表.
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是______.
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是______ (选填“甲”、“乙”、“丙”).
-
X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的 键和
键和 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。
-
X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表:
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是:____________。比Q元素原子序数大3的元素的原子结构示意图为 。
(2)比较Y元素与氧元素的第一电离能大小顺序 ;X和Z形成的化合物XZ2为一种液体溶剂,其电子式为 。
(3)写出实验室制备M单质的离子方程式:_____________。
(4)M的气态氢化物和氟化氢相比稳定性强的是___________(写化学式)。
-
四种短周期元素的性质或结构信息如下表所示。请根据信息回答下列问题。
| 元素 | T | X | Y | Z |
| 性质或结构信息 | 原子核外s能级上的电子总数等于p能级上的电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 其单质为双原子分子,分子中含有3对共用电子对,常温下其气体单质性质稳定,但其原子较活泼 | 其单质质软,是银白色固体,导电性强。单质在空气中燃烧发出黄色火焰 | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图:______;写出元素X的气态氢化物的分子式:______;写出Z元素原子的核外电子排布式:________;元素Y的原子核外共有_______种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:______。
(3)元素T与氟元素相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下氟气的颜色比T单质的深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素显正价
d.比较两元素的单质与氢气化合时得电子的数目
-
已知 X、Y、Z、M、R五种元素中,原子序数依次增大,其结构或性质信息如下表。请根据信息回答有关问题:
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 在元素周期表的各元素中电负性仅小于氟 |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
(1)元素M的原子核外有 ______ 种不同运动状态的电子;
(2)五种元素中第一电离能最高的是_______写元素符号;
(3)在Y形成的单质中, 键与
键与 键数目之比为______,在
键数目之比为______,在 中Z原子的杂化方式为_____,其分子的空间构型为 ______;
中Z原子的杂化方式为_____,其分子的空间构型为 ______;
(4)R的一种配合物的化学式为 。已知
。已知 在水溶液中用过量硝酸银溶液处理,产生
在水溶液中用过量硝酸银溶液处理,产生 AgCl沉淀,此配合物最可能是 ______填序号。
AgCl沉淀,此配合物最可能是 ______填序号。
A. B.
B.
C.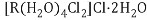 D.
D.
-
已知X、Y、Z、W、Q、R、E七种元素中,原子序数X<Y<Z<W<Q<R<E,其结构或性质信息如下表。
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 元素的原子最外层电子排布式为nsnnpn+1 |
| Z | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子 |
| W | 元素的正一价离子的电子层结构与氩相同 |
| Q | 元素的核电荷数为Y和Z之和 |
| R | 元素的正三价离子的3d能级半充满 |
| E | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
请根据信息回答有关问题:
(1)元素X的原子核外共有____种不同运动状态的电子,有____种不同能级的电子。
(2)元素Y原子中能量最高的是____电子。
(3)Q的基态原子核外电子排布式为________,R的元素符号为____,E元素原子的价电子排布式为_____。
(4)含有元素W的盐的焰色反应为____色,许多金属形成的盐都可以发生焰色反应,其原因是__________________________________________。
-
【化学-物质结构与性质】(12分) X 、Y 、Z 、W是元素周期表前四周期的4种常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第________周期________族;Y和Z的最高价氧化物对应的水化物的酸性较强的是________(写化学式)。
(2)XY2是一种常见溶剂,XY2的分子中存在________个σ键。在H-Y、H-Z两种共价键中,键的极性较强的是________(用化学式表示),键长较长的是________(用化学式表示)。
(3)W的基态原子核外电子排布式是________。
W2Y 在空气中煅烧生成 W2O 的化学方程式是:
________。
(4)处理含 XO 、YO2 烟道气污染的一种方法,是将其在催化剂作用下转化为单质 Y。已知:
XO (g) +1/2O2 (g) = XO2 (g) ;△H=-283.0kJ/mol
Y (s) + O2 (g) = YO2 (g) ;△H=-296.0kJ/mol
此反应的热化学方程式是:________。
-
(13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 A B C D
性质
结构
信息 原子核外有两个电子层,最外层有3个未成对的电子 原子的M层有1对成对的p电子 原子核外电子排布为[Ar]3d104s1,
有+1、+2两种常见化合价 有两种常见氧化物,其中有一种是冶金工业常用的还原剂
⑴写出B原子的电子排布式________。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点________(填“高”或“低”),其是__________________________。
⑶D的最高价氧化物的电子式:________。高温下D的氧化物还原赤铁矿的方程式为可逆反应,写出该反应的化学方程式___________________,该反应的平衡常数表达式K=___________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
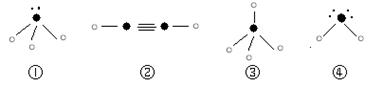
则在以上分子中,中心原子采用sp3杂化形成化学键的且空间构型是角形的是________(填写序号);在②的分子中有________个σ键和________个π键。
⑹已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H(→表示共用电子对由N原子单方面提供)。 请画出N4H44+的结构式_____________________。


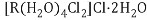 D.
D.