-
(14分)为测定一置于空气中的某硫酸酸化的FeS04溶液中Fe2+被氧化的百分率,某同学准确量取pH=l(忽略Fe2+、Fe3+的水解)的FeS04溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeS04溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。
(1)通过计算,填写下表:
C(H+)
C(SO42—)
C(Fe2+、Fe3+)
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系。
高三化学计算题简单题查看答案及解析
-
为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+)
c(SO42﹣)
c(Fe2+、Fe3+)
__
__
__
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.
高三化学计算题中等难度题查看答案及解析
-
(14分)高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下:
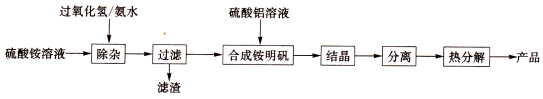
(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。检验Fe2+已除尽的实验操作是 。
(2)通常条件下,KSP[Fe(OH)3]=4.0×10-38,除杂后溶液中c(Fe3+)= 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是 。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作名称是 (填字母代号)
a.蒸馏 b.分液 c.过滤
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.102g;
b.称取0.906g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经静置、过滤、洗净,得BaSO40.932g;
c.称取0.906g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0340g。
则铵明矾的化学式为 。
(7)有同学认为,第(6)问测定铵明矾组成的方法a、b、c三个试验中,有一个实验不必实施也能推导出铵明矾的化学式,您认为合理吗?若合理,请在下列空格写出不必实施的实验代号(即填上a、b、c其中的一个);若不合理,则在下列空格填上“不合理”,你的结论是 。
高三化学实验题极难题查看答案及解析
-
“酸化”是实验中经常采用的方法,下列“酸化”错误的是
A. 提高高锰酸钾的氧化能力,用浓盐酸酸化
B. 抑制Fe2(SO4)3的水解,用稀硫酸酸化
C. 确认溶液中含有Cl-时,先用硝酸酸化,再加Ag+检验
D. 确认溶液中含有SO42-时,先用盐酸酸化,再加Ba2+检验
高三化学单选题简单题查看答案及解析
-
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )

A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是
D.石墨电极上发生的反应是4OH--4e-
O2↑+2H2O
高三化学选择题中等难度题查看答案及解析
-
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )

A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是
D.石墨电极上发生的反应是4OH--4e-
O2↑+2H2O
高三化学选择题中等难度题查看答案及解析
-
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是

A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是
D.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
高三化学选择题中等难度题查看答案及解析
-
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是( )

A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是
高三化学选择题简单题查看答案及解析
-
己知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL。下列说法正确的是

A. 铜电极连接电源正极 B. 铜的相对原子质量的计算式是
C. 黑色粉末X是铁粉 D. 石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
高三化学单选题困难题查看答案及解析
-
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL.下列说法正确的是( )

A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是
D.石墨电极上发生的反应是4OH﹣﹣4e﹣=O2↑+2H2O
高三化学选择题中等难度题查看答案及解析