-
钼酸钠晶体(Na2MoO4·2H2O)可用于制造生物碱、油墨、化肥、钼红颜料、催化剂等,也可用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
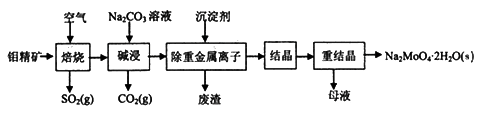
回答下列问题:
(1)Na2MoO4中Mo的化合价为____________。
(2)“焙烧”时,Mo元素转化为MoO3,反应的化学方程式为____________,氧化产物是________(写化学式)。
(3)“碱浸”生成CO2和另外一种物质,CO2的电子式为_______,另外一种生成物的化学式为______。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,SO42-的去除率为______%。(小数点后保留一位数字)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害冷水系统的金属抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
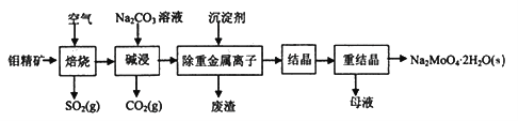
回答下列问题:
(1)提高焙烧效率的方法有__。(写出两种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的氧化产物是__(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__。钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?__。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)“重结晶”过程的具体操作是:__。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
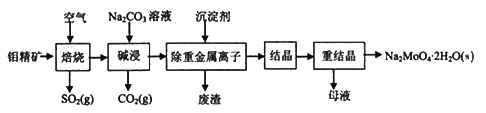
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
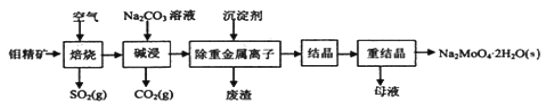
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为_____________,氧化产物是________(写化学式)。每转化生成1molMoO3时,需要转移的电子数是 _________。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
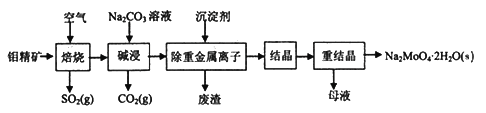
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?_________________________________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
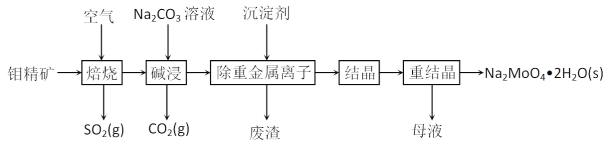
回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________,氧化产物是______。
(3)“碱浸”时生成CO2的电子式为_______,碱浸”时含钼化合物发生的主要反应的离子方程式为_____。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为______。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO42-的质量分数为_____%。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
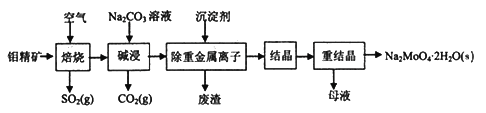
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
-
钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
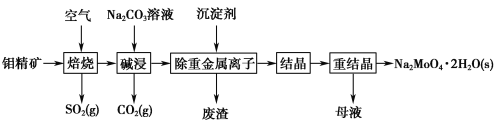
根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有______________________________。(写任意一种即可)
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是________。
(3) “碱浸”时生成CO2的电子式为________,“碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO 的质量分数为________%。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
的质量分数为________%。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO 生成,该反应的离子方程式为__________________________。
生成,该反应的离子方程式为__________________________。
-
钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
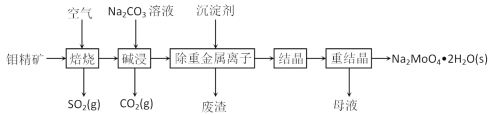
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
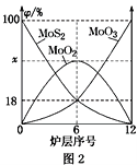
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕










