-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
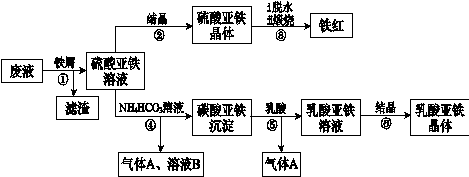
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是________________________。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、________________________________。
(1)步骤④的离子方程式是________。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及________________________。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________________________。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)________。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
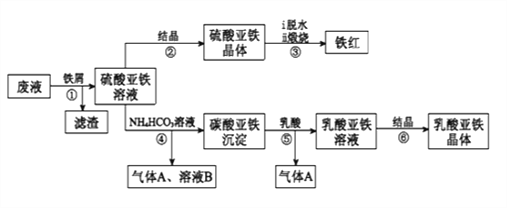
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如图:
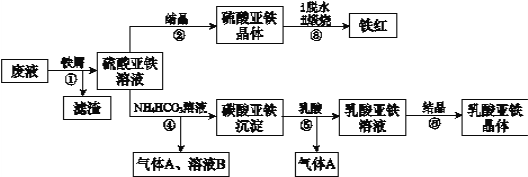
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是______________________。
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式为_____。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为______________。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 ____________________________。
(5)步骤④的离子方程式为___________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)___________________。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、 TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:
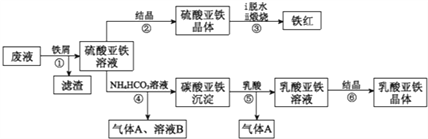
已知:TiOSO4可溶于水,在水中可以电离为TIO2+和SO42-,TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)步骤①中分离硫酸重铁溶液和滤渣的操作是______________。
(2)加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因_______________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因___________________。
(5)步骤④的离子方程式是________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______________。
(7)乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是_______________。
经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
| 滴定次数 | 0.1000mol/LCe(SO4)2标准溶液/mL |
| 滴定前读数 | 滴定后读数 |
| 1 | 0.10 | 19.85 |
| 2 | 0.12 | 21.32 |
| 3 | 1.05 | 20.70 |
| 4 | 0.16 | 19.88 |
则产品中乳酸亚铁晶体的纯度为_______(以质量分数表示)。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
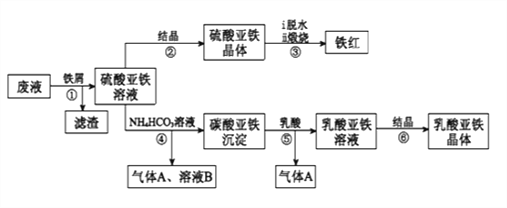
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
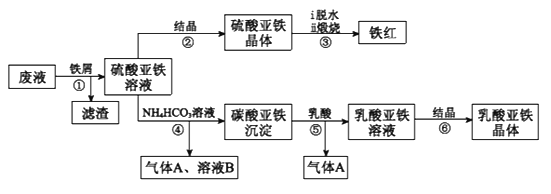
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______(用a表示)。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
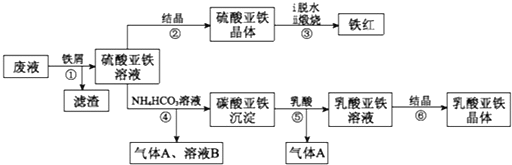
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___________,步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________。
(2)步骤④的离子方程式是_______________。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)____________。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
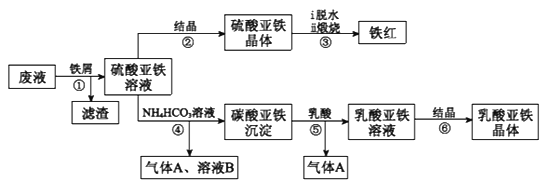
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______(用a表示)。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁.其生产步骤如图:
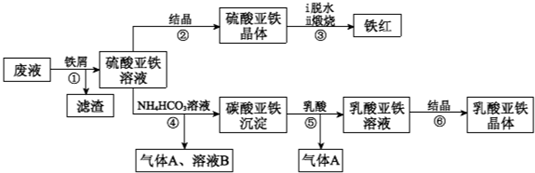
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________.
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式________.
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________.
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________.
(5)步骤④的离子方程式是________.
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及________.
(7)为测定步骤②中所得晶体中FeSO4•7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000mol•L-1 KMnO4溶液20.00mL,所得晶体中FeSO4•7H2O的质量分数为(用a表示)________.
-
利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:
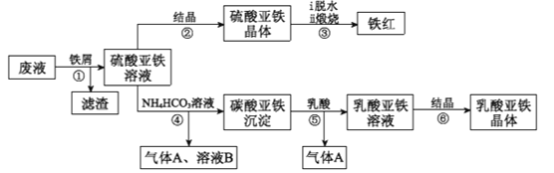
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。









