-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g) △H,随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g) △H,随温度升高,混合气体的颜色变深。回答下列问题:
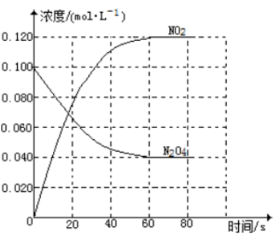
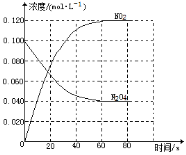
(1)反应的△H 0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(NO2)为 mol·L-1·s-1,反应的平衡常数K为 。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”或“小于”)。

(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
-
(1)在容积为1.00L的容器中,通入一定量的N2O4发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的△H_______0(填“大于”“小于”);
②100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_________mol·L-1·s-1反应的平衡常数K为__________。

(2)在恒容密闭容器中通入X 并发生反应:2X(g) = Y(g);温度T1、T2下X的物质的最浓度c(X)随时间t 变化的曲线如右图所示。

①T1____T2 (填“大于”或“小于”)。
②M点的正反应速率V正____N点的逆反应速率V逆(填“大于”,“小于”或“等于”)。
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s) + Br2(g) ΔH= + 105. 4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为_______。
-
(1)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
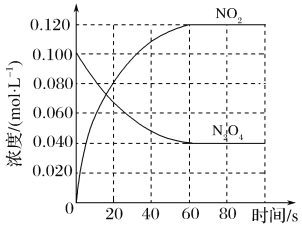
该反应ΔH______0(填“>”、“<”或“=”),在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。平衡常数K=________________(请书写单位)。在温度不变的情况下向平衡体系中再充入N2O4 0.01mol·L-1和NO20.03mol·L-1此时v(正)___________v(逆)(填“>”、“<”或“=”)。有利于提高反应N2O4(g)  2NO2(g)平衡转化率的条件是________(填标号)。
2NO2(g)平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在一定温度下,向a L密闭容器中加入1 molN2O4(g)发生如下反应:N2O4(g)  2NO2(g),不能说明该反应一定达平衡的是__________。
2NO2(g),不能说明该反应一定达平衡的是__________。
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1:2:2
D.单位时间内生成1 mol N2O4(g),同时生成2 mol NO2
E.混合气体的密度不随时间变化
F.混合气体的颜色不随时间变化
(3)在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是__________
A. 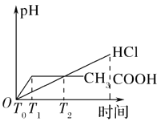 B.
B. 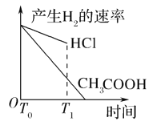
C. 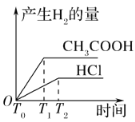 D.
D. 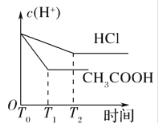
(4)25 ℃时,一元弱酸HA溶液Kal=4.3×10-4 ,一元弱酸HB溶液Ka2=5.6×10-4则酸性HA____________HB(填“>”、“<”或“=”)。
(5)常温下0.001mol·L-1的H2SO4溶液与0.004mol·L-1的NaOH溶液1:1体积比混合,混合后溶液的pH=_____________。
-
(12分)
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1= 。

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②温度T时反应的平衡常数K2 =
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断的理由是: 。
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是: 。
-
(13分)在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 。 反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②100℃时达到平衡后,向容器中再充入0.20mol NO2气体,新平衡建立后,NO2的体积分数
(填“增大”、“不变”或“减小”)
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”“小于”),判断理由是 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4 (g) 2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H ___0(填“﹥”或“﹤”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___________mol·L-1·s-1,反应的平衡常数K为_______mol·L-1。

(2)100℃时,在容积为1.00L的容器中,通入1mol NO2(g)和1mol N2O4(g),此时v正_______ v逆(填“>”或“<”或“=”)。
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。
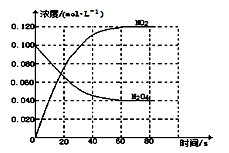
在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1,
平衡时混合气体中NO2的体积分数为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),
②列式计算温度T时反应的平衡常数K 。
(3)温度T时反应达平衡后,向容器中,迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正) v(逆)。(填“大于”,“等于”,或“小于”)
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”“小于”),判断理由是 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol•L﹣1•s﹣1。

(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”或“小于”),判断理由是_______________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动。
(4)在2NO2⇌N2O4的可逆反应中,下列状态一定属于平衡状态的是(____)
A.N2O4和NO2的分子数比为1:2 B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:





 B.
B. 
 D.
D. 






