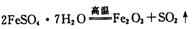-
硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
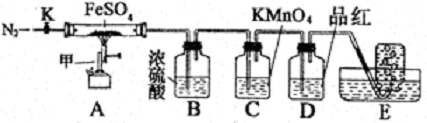
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4) FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
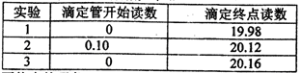
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
-
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解产生水、金属氧化物和非金属氧化 物,某化学兴趣小组的同学对绿矾分解产物进行了探究,下列说法不正确的是( )
A. 硫酸亚铁晶体高温分解产生的气体,用足量的BaCl2溶溶液吸收后有白色沉淀产生,说明非金属氧化物中含有SO3
B. 硫酸亚铁晶体高温分解产生的气体,通入到紫色石蕊溶液中,若溶液变红,说明非金属氧化物中含有SO3
C. 硫酸亚铁晶体分解产生的固体溶于稀硫酸后,向溶液中滴加KSCN溶液,若变红说明固体中含有三价铁
D. 硫酸亚铁晶体分解产生的固体溶于稀硫酸后,向溶液中滴加酸性高锰酸钾,若紫色褪去,则发生反应的离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
-
硫酸亚铁晶体(FeSO4·7H2O)俗称绿矾,加热至高温会发生分解,为确定绿矾分解产生的非金属氧化物,进行如下探究:
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:_________________________________。
(2)现设计如下所示实验装置(图中铁架台略去),检验绿矾的分解产物。
按上述装置进行实验,同学们观察到如下现象:
| 装置 | 现象 | 结论 |
| A | 固体呈现红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | ______________ |
| B | 无水硫酸铜变蓝 |
| C | 高锰酸钾溶液褪色 |
(3)结合实验现象,理论上分析可知绿矾分解还生成另一物质SO3。其理论依据是________________________________________________。
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左→右),注明药品的名称[可供选择的药品有1 mol·L-1 NaOH溶液、0.5 mol·L-1 BaCl2溶液、0.5 mol·L-1 Ba(NO3)2溶液]。
| 装置示意图 | 现象及结论 |
| ______ | ________________,说明分解产物中有SO3 |
(5)根据上述实验,写出绿矾高温分解的化学方程式:______________________。
-
FeSO4·7H2O俗称绿矾,广泛用于医药和工监领域。
(1)已知FeSO4·7H2O晶体在加热条件下发生如下反应:
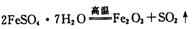
 。利用下图装置检验该反应的气体产物。
。利用下图装置检验该反应的气体产物。
请填写下列空白:
①仪器的连接顺序为________(用a~i的字母表示)。
②装置C中的试剂X化学式为________;该装置中冷水的作用是________。
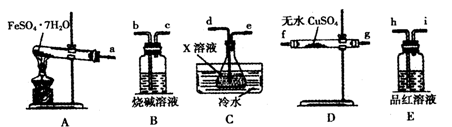
(2)以下是FeSO4·7H2O的实验窒制备流理图。
根据题意完成下列填空:
①反应Ⅱ需要l00mL l.5mol·L-1l的稀硫酸溶解洁净的铁屑,用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及________,量取浓硫酸的体积为________。
②反应1需要加热数分钟,其原因是________;操作A为________。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01000moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。发生反应的离子方程式为________,计算上述样品中FeSO4·7H2O的质量分数为________(保留两位有效数字)。
-
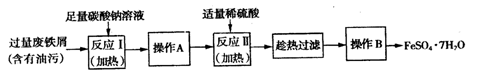
隔绝空气加热至500℃时绿矾(硫酸亚铁晶体)能完全分解,某化学小组为探究分解产物的成分,选用下图所示装置进行实验(夹持装置略),A中固体完全分解后变为红棕色粉末。
下列说法不正确的是
A. 所选用装置的正确连接顺序为A-C-E-D-B
B. E装置是用来检验SO3,则X可以是硝酸酸化的硝酸钡溶液
C. 可选用酸性KMnO4溶液检验A装置中残留固体是否为Fe2O3
D. 该反应的化学方程式可能是2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
-
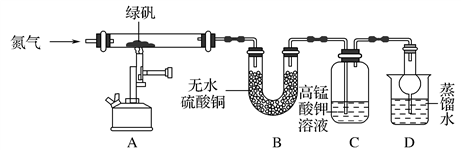
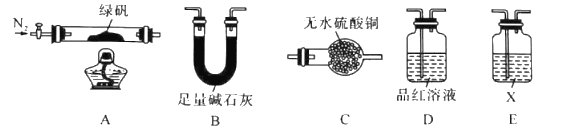
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
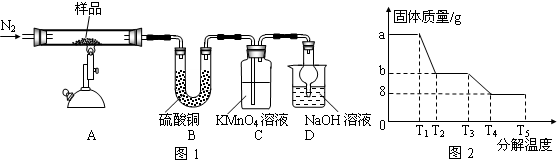
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有________。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式________。
(5)装置D球形干燥管的作用________。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
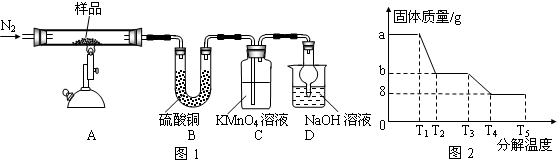
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式。
(5)装置D球形干燥管的作用。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x
=_________________________。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
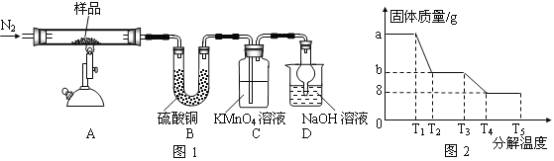
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
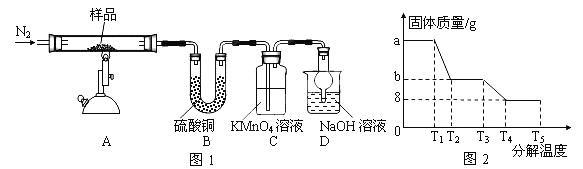
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 _____。
(2)实验中要持续通入氮气,否则测出的x会 ___(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3 。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3 ,写出FeSO4 分解的化学方程式 __。
(5)装置D球形干燥管的作用 ____。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x= _____。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
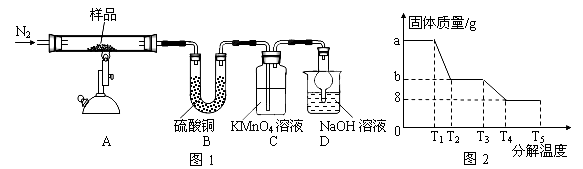
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。