-
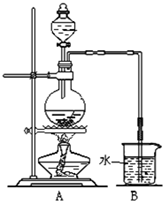
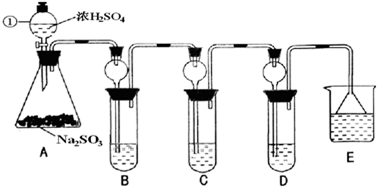
(16分)某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是 。
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹。此操作的目的是 。
(3)实验过程装置B中没有明显变化。实验结束取下装置B,从中分别取少量溶液于两支洁净试管中。向第1支试管中滴加适量氨水出现白色沉淀 (填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是 。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有 性。
(5)装置D的作用是 。
(6)实验后,测定装置D中溶液呈碱性。溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种假设成立。可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | | |
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样。并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验。请计算该空气中SO2的体积分数(用含V的代数式表示) 。
-
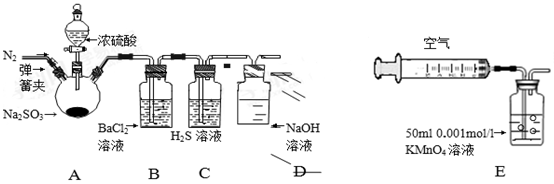
某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是________.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性.
(5)装置D的作用是______。
(6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。
-
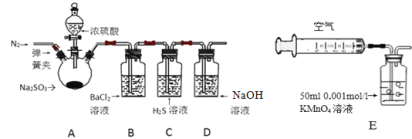
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
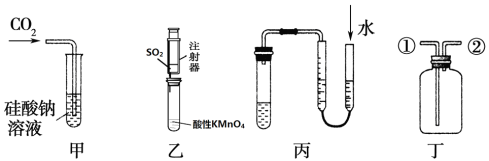
A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:可用来探究SO2的漂白性
C.丙装置:用图示的方法可以检查此装置的气密性
D.丁装置:从①口进气可集满二氧化碳,从②口进气,可收集氢气。
-
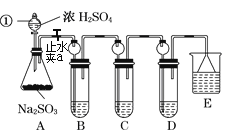
某研究小组欲探究SO2的化学性质,设计了如下实验方案.
(1)指出仪器①的名称______.
(2)检查A装置的气密性的方法是______.
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为______.
(4)装置C中盛装溴水用以检验SO2的______性,则C中反应的离子方程式为______.
(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3
假设二:该白色沉淀为______.
假设三:该白色沉淀为上述两种物质的混合物.
②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.
第1步,将D中沉淀过滤、洗涤干净,备用.
请回答洗涤沉淀的方法:______.
第2步,用另一只干净试管取少量沉淀样品,加入______(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有______(试剂)的试管中.
若出现______现象,则假设一成立.
③若假设二成立,试写出生成该白色沉淀的化学方程式:______.
(6)装置E中盛放的试剂是______,作用是______.
-
某研究小组欲探究SO2的化学性质,设计了如下实验方案。
(1) 指出仪器①的名称:______________。
(2) 检查A装置的气密性的方法是______________________________________________。
(3) 装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4) 装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
___________________________________________________。
(5) 装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
① 假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为____________;
假设三:该白色沉淀为上述两种物质的混合物。
② 基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:___________________________。
(6) 装置E中盛放的试剂是________,作用是________________________________。
-
直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
-
某研究小组欲探究SO2的化学性质,设计了如下实验方案。
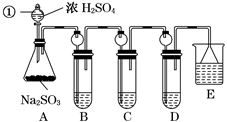
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
-
CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
该小组用下图所示装置进行实验(夹持仪器略)

已知实验操作的步骤为:a.检查装置的气密性后加入药品→b.在“气体入口”处通入干燥HCl→c.点燃酒精灯,加热→d.反应一段时间,熄灭酒精灯,冷却→e.停止通入HCl,然后通入N2
(资料查阅)
请回答下列问题:
(1)仪器X的名称是___________。
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是___________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息
①若杂质是CuCl2,则产生的原因是_______________。
②若杂质是CuO,则产生的原因是___________。
-
碱式碳酸铜可用作木材防腐剂、水体杀藻剂等,研究性学习小组设计以下方案制备碱式碳酸铜并进行相关实验探究。
Ι.以铜屑为原料制备碱式碳酸铜的装置如下:
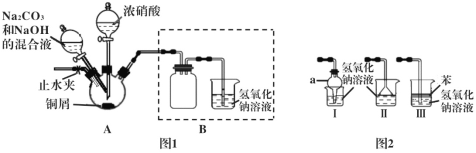
步骤1 连接好装置,检查装置的气密性,装药品。
步骤2 往三颈烧瓶中加入适量的浓硝酸,使铜屑完全反应。
步骤3 往步骤2反应后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加热。
步骤4 将三颈烧瓶中的混合物过滤、洗涤、烘干,获得产物。
已知:ⅰ.碱式碳酸铜为草绿色或绿色结晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能单独与NaOH溶液反应。
(1)步骤2中浓硝酸与铜屑反应的离子方程式为___________________。
(2)步骤2反应一段时间后,须打开止水夹,通入一段时间的空气,目的是_______。
(3)步骤3对装置A的加热方式最好采用____________。
(4)装置Ι中仪器a的名称为____,Ⅰ、Ⅱ、Ⅲ三个装置不能替代图1中B装置的是_____(填装置序号)。
(5)欲检验步骤4获得的产物中是否含有NO3-,所需的试剂可以是__________。
Ⅱ.探究在一定温度下,不同的原料配比对产物的影响,实验数据如下:
| 实验序号 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀数量 | 沉淀颜色 |
| 1 | 2.0 | 2.0 | 1.6 | + | 浅绿色 |
| 2 | 2.0 | 2.0 | 2.0 | + + | 浅绿色 |
| 3 | 2.0 | 2.0 | 2.4 | + + + | 蓝色 |
| 4 | 2.0 | 2.0 | 2.8 | + + + | 蓝色 |
注:“+”越多表示沉淀量越多
(6)分析表格数据可得:制备碱式碳酸铜最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.产物组成的测定
(7)碱式碳酸铜的成分有多种,化学式可表示为mCu(OH)2·n CuCO3。为测定Ι中所得碱式碳酸铜的组成,学习小组同学准确称取3.820 g样品溶于适量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于锥形瓶中,加适量水稀释,调节溶液pH至3~4,加入过量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3标准溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失。进行平行实验后,测得平均消耗Na2S2O3标准溶液的体积为35.00 mL。该碱式碳酸铜的化学式为_____
-
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
(1)请简述如何检查该装置的气密性.______.
(2)写出A装置中发生反应的离子方程式______ Mn2++C12↑+2H2O