-
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g) CH3OH(g) ΔH1 CH3OH(g) ΔH1 | K1 |
| ② | 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-24 kJ/mol CH3OCH3(g)+H2O(g) ΔH2=-24 kJ/mol | K2 |
| ③ | CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41 kJ/mol CO2(g)+H2(g) ΔH3=-41 kJ/mol | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | 
| C=O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算ΔH1= 。
(2)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH= ,化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
(5)以=2 通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是____。
CH3OCH3(g)+H2O(g) ΔH,其CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是____。
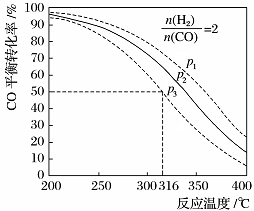
A.该反应的ΔH>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1 mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2 L的密闭容器中,发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= 。
CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= 。
-
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g) CH3OH(g) ΔH1 CH3OH(g) ΔH1 | K1 |
| ② | 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-24kJ/mol CH3OCH3(g)+H2O(g) ΔH2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41kJ/mol CO2(g)+H2(g) ΔH3=-41kJ/mol | K3 |
回答下列问题:
工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是___。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
| 化学反应方程式 | | 化学平衡常数 |
| ①CO(g)+2H2(g) CH3OH(g) CH3OH(g) | ΔH1=-99 kJ•mol-1 | K1 |
| ②2CH3OH(g) CH3OCH3(g)+H2O(g) CH3OCH3(g)+H2O(g) | ΔH2=-24 kJ•mol-1 | K2 |
| ③CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) | ΔH3=-41 kJ•mol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
-
开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=
CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K= ,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L-1,c(H2)=1.4mol·L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为___。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L-1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
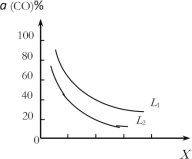
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
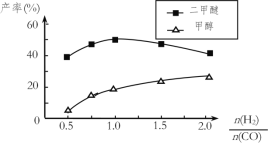
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
-
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
① CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
① 由表中数据判断ΔH 0 (填“ >”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
② 某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。
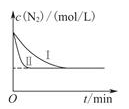
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。
-
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

(1)催化反应室B中CO与H2合成二甲醚的化学方程式为________.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为________。
×100%,试求反应(Ⅳ)的原子利用率为________。
②反应(Ⅳ)的△S ________0(填“>”、“=”或“<”)。
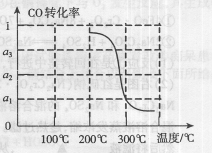
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H________0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= ________(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽车燃油、石油液化气、城市煤气等,市场前景极为广阔。它清洁、高效,具有优良的环保性能。
工业上制二甲醚是在一定温度(230~280 ℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应。
CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 ③
(1)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
(2)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH>0。
该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是________。
A.容器内混合气体的密度不变
B.容器内混合气体的压强保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗2 mol CO2的同时消耗1 mol二甲醚
(3)二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚与乙醇互为同系物
D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
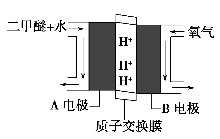
(4)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),写出A电极的电极反应式:________________________________________。
-
以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应

(1)该工艺的总反应为3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)△H
CH3OCH3(g)+CO2(g)△H
该反应△H=_______________,化学平衡常数K=__________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有___________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是_________________________。
-
(8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)=2:1:1
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻测定出该反应中各物质的浓度为c(CH3OH)=0.3 mol/L、c(CH3OCH3)=0.6 mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ∆H=-a kJ/mol ②
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)

A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3 ③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol ④
H2O(l)=H2O(g) △H5=+44KJ/mol ⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)
-
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)Ⅱ和Ⅰ相比,改变的反应条件是 .
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= .
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)= .
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是 .
CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+H2O(g) ΔH,其CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是____。

CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= 。









