-
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.写出此反应的化学方程式______.
(2)上述反应中的氧化剂是______,氧化产物是______.
(3)As2S3和HNO3有如下反应:As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O 若生成1mol H3AsO4,则反应中转移电子的物质的量为______.
(4)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O的反应中,有6.4g铜被氧化,参加反应的HNO3的质量是______g,被还原的HNO3的质量是______g.
(5)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol Cr2O72-反应所需PbO2的物质的量为______.高一化学解答题中等难度题查看答案及解析
-
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
高一化学填空题简单题查看答案及解析
-
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(2)As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应生成的气体用烧碱溶液吸收,则该反应的离子方程式为 。
(3)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,反应的化学方程式为 ,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
高一化学填空题困难题查看答案及解析
-
2019年的全国高考与传统节日端午节相遇。端午节习俗之一是喝雄黄酒。雄黄是As4S4,其中元素As的原子序数比S的两倍多1。下列说法正确的是( )
A.气态氢化物稳定性:As>S
B.As元素在周期表中位置为ⅦA族
C.As最高价氧化物对应的水化物为强酸
D.As位于金属与非金属分界线附近
高一化学单选题简单题查看答案及解析
-
自然界的矿物中有一种重晶石矿的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用,某课外活动小组同学,用重晶石和焦炭为原料,制取纯净硫酸钡,部分流程如下(设矿物中杂质不与焦炭反应,也不溶于水):
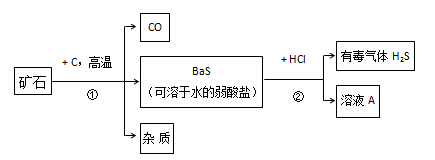
按要求填空:
(1)在步骤①中,哪些元素的化合价升高了,哪些元素化合价降低了?__________________。
(2)写出步骤②溶液A中溶质的化学式:_________________________。
(3)写出利用溶液A中的溶质主要原料制取Ba(OH)2 的化学方程式:_________________。
(4)有同学指出,上述步骤②产生有毒气体H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S又能获得纯净BaSO4,并写出有关反应的化学方程式。
高一化学实验题简单题查看答案及解析
-
下面叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
B.水泥是重要的硅酸盐产品,以纯碱、石灰石、二氧化硅为原料
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅是一种亲氧元素,在自然界中它总是与氧相互化合
高一化学选择题中等难度题查看答案及解析
-
下列有关硅的叙述中,正确的是
A. 工业上通常以SiO2为原料,用氧化剂与其反应制备单质硅
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一 位
C. 硅的化学性质不活泼,在自然界中可以以游离态存在
D. 硅在电子工业中,是重要的半导体材料
高一化学选择题中等难度题查看答案及解析
-
下列有关硅的叙述中,正确的是
A.工业上通常以SiO
为原料,用氧化剂与其反应制备单质硅
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
高一化学选择题中等难度题查看答案及解析
-
有关硅元素的下列叙述中正确的是( )
A.硅、碳与氢氟酸都不反应
B.硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
C.硅与碳性质都很稳定,都能以游离态存在于自然界
D.晶体硅、石墨都可作半导体材料
高一化学单选题简单题查看答案及解析
-
下列关于硅及其化合物的说法正确的是
A.SiO2是酸性氧化物,硅酸的酸酐,但是它不与水、烧碱反应
B.硅元素是自然界构成岩石、矿物的主要成分,其单质是半导体,不与任何酸碱反应
C.硅酸钠溶液加入盐酸产生白色浑浊,再加入足量的烧碱,溶液恢复澄清
D.硅酸钠溶液中缓慢通入足量二氧化碳,先产生浑浊后恢复澄清
高一化学选择题中等难度题查看答案及解析