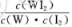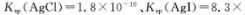-
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性。
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
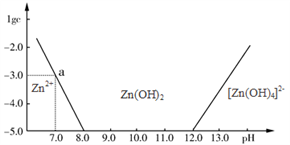
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为:
___________________________________________________________________________
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)= _________________________。
③往1L1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol。
④已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
| c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是____________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50 mol·L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
①在25℃下,将a mol•L—1的NH4Cl溶液与0.01mol•L—1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=___________mol • L—1。
②若25℃时将浓度均为0.1mol•L—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____________(填字母)。
a.此溶液一定有c(NH4+)+ c ( H+) = c(OH—) +c ( Cl—)
b.此溶液一定有c(Cl-) = c (NH3·H2O) +c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
-
铍和铝在元素周期表中具有特殊的“对角线关系”,两种元素的单质和化合物的性质相似。下列有关铍的说法不正确的是( )
A.Be(OH)2 难溶于水
B.BeCl2溶液能导电,说明BeCl2一定是离子化合物
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.Be可以和氧气、氯气等非金属单质发生反应
-
下列对金属单质及其化合物性质的描述不正确的是
①在金属活动顺序表中位于前面的金属均可将后面的金属从它的盐溶液中置换出来
②镁、铝、锌均是活泼金属,它们的单质在空气中均不能稳定存在
③电解Cu(NO3)2、AgNO3的混合溶液时在阳极上一定先析出银
④2Fe3++Cu =2Fe2++Cu2+,说明铜的还原性强于单质铁
⑤常温下浓硫酸几乎不与铜反应,说明浓硫酸也能使铜钝化
⑥金属元素形成的弱碱对热不稳定,受热时可以分解成相应的氧化物
A. ①②③④⑤⑥ B. ②③④⑤⑥
C. ①④⑤⑥ D. ①②③⑤
-
某短周期金属元素原子核外最外层电子数是最内层电子数的1.5倍,下列说法正确的是( )
A.该元素的单质性质活泼,具有较强的还原性,可以用于某些金属冶炼
B.该元素的单质常温下不与浓硫酸反应
C.该元素的单质无需特别保存,因为其性质稳定,不易与空气中的成分反应
D.该元素的最高价氧化物对应的水化物只能与酸反应
-
工业上通过反应“SiO2+2C Si+2CO↑”制取单质硅,下列说法正确的是( )
Si+2CO↑”制取单质硅,下列说法正确的是( )
A. 自然界中硅元素均以SiO2形式存在
B. 硅的化学性质不活泼,常温下不与任何物质反应
C. 该反应条件下C的还原性比Si强
D. 生成4.48 L CO时转移电子数为0.4×6.03×1023
-
常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数.下列说法正确的是( )
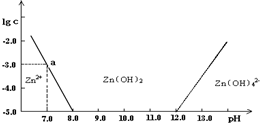
A.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
B.pH<12的溶液中不存在Zn(OH)42-
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L 1mol•L-1ZnC12溶液中加入NaOH固体至pH=7,需NaOH 2mol
-
某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.
请用化学用语回答下列问题:
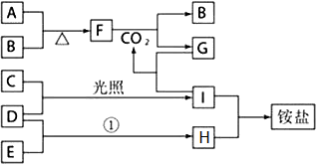
(1)B是 ______ ,化合物G的焰色反应为 ______ ;
(2)将F溶于水后形成的溶液可吸收C,写出该反应的离子方程式 ______________________________ ;
(3)写出实验室制取氨气的化学方程式: ______________________________ ,收集氨气应使用 ______ 法,要得到干燥的氨气通常选用 ______ 做干燥剂.
-
下列说法中正确的是
A.元素的非金属性越强,其单质的活泼性一定越强
B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.含有金属阳离子的晶体一定是离子晶体
-
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:

写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
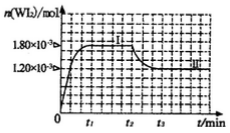
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=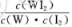
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时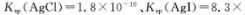
 ]。
]。
-
(15分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;
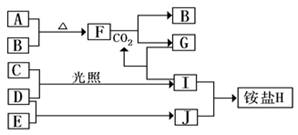
请完成下列填空:
(1)H的化学式________、F的电子式________。
(2)F和CO2的化学方程式________。
写出G溶液中逐滴加入等物质的量的I溶液反应的离子方程式________。
(3)A与B 在加热条件下反应的主要现象是________;
(4)检验H 中阳离子的方法是________。