-
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.
Ⅰ、某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:
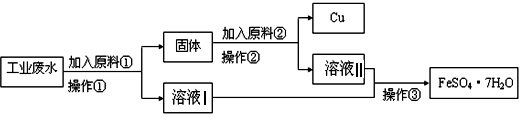
(1)反应①的离子方程式为 。
(2)操作①中用到的玻璃仪器是______ (填序号)。
a.烧杯 b.漏 斗
斗  c.玻璃棒 d.酒精灯
c.玻璃棒 d.酒精灯
(3)固体成份是 (填名称)。
(4)原料②的名称为 。
Ⅱ、回收的铜可用于制备胆矾(CuSO4·5H2O)。,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
①请分析2Cu+2H2SO4+O2 2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
②用双线桥标出上述反应的电子得失。2Cu+2H2SO4+O2 2CuSO4 + 2H2O
2CuSO4 + 2H2O
-
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.
Ⅰ、某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:

(1)反应①的离子方程式为 。
(2)操作①中用到的玻璃仪器是______ (填序号)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是 (填名称)。
(4)原料②的名称为 。
Ⅱ、回收的铜可用于制备胆矾(CuSO4·5H2O)。,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
①请分析2Cu+2H2SO4+O2 2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
②用双线桥标出上述反应的电子得失。2Cu+2H2SO4+O2 2CuSO4 + 2H2O
2CuSO4 + 2H2O
-
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。请回答:

(1)反应①的离子方程式为______。
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成分是_____。(填名称)。
(4)原料②的名称为_____。
Ⅱ.回收的铜可用于制备胆矾(CuSO4·5H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 2CuSO4+2H2O。 制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾。
2CuSO4+2H2O。 制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾。
(1)请分析2Cu+2H2SO4+O2 2CuSO4+2H2O反应中,氧化剂是_____,氧化产物是____(填化学式)。
2CuSO4+2H2O反应中,氧化剂是_____,氧化产物是____(填化学式)。
(2)用双线桥标出上述反应的电子得失_____。
2Cu+2H2SO4+O2 2CuSO4+2H2O
2CuSO4+2H2O
(3)若有147gH2SO4 参与反应,则转移的电子数目为_____。
-
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计下图工艺流程以回收铜和硫酸亚铁。请回答:

(1)加入原料①反应的离子方程式为_____
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 C.玻璃棒 d.酒精灯
(3)加入原料②的名称为_____
Ⅱ.回收的铜可用于制备胆矾(CuSO4•5H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2═2CuSO4+2H2O,制得硫酸铜溶液后,经过蒸发浓缩冷却结晶、过滤可得胆矾
(1)请分析2Cu+2H2SO4+O2 2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
(2)用双线桥标出反应中电子转移的方向和数目______________________
(3)若有147gH2SO4参与反应,则反应转移的电子数目为_____
-
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.为了减少污染,变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁.请回答:
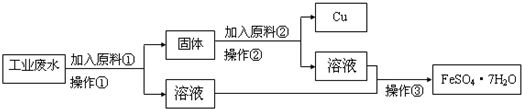
(1)原料①为________(填化学式).
(2)写出加入原料②后反应的离子方程式:________.
(3)若在实验室中完成该流程,操作②需要用到的玻璃仪器的名称是________、
________、________;整个实验操作过程中不可能用到的装置是________(填字母).

-
某工厂的工业废水中含有大量的Fe2+、Cu2+、SO42-和Na+,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁及金属铜,请根据下列流程在标有①﹣⑤的方框和括号内填写物质名称或操作方法,完成回收硫酸亚铁及金属铜的简单实验方案。
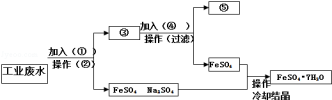
请完成流程图空白:
① 。② 。
③ 和 。④ 。
⑤ 。
-
(10分)某工厂的工业废水中含有大量的Fe2+、SO42-和较多的Cu2+及少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和 括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实 验方案。
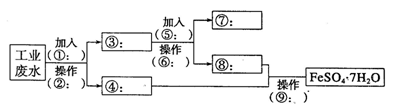
(1)操作②的名称为__________,所需要的玻璃仪器为__________、__________、烧杯。
(2)试剂⑤的化学式为__________,发生化学反应的离子方程式为__________。
(3)为验证溶液⑧中含有SO42-:取少量的溶液⑥于试管中,先加入____再加入__________,若观察到有白色沉淀,则说明溶液⑧中含有SO42-。写出上述反应的离子方程式______________________________.
-
某工厂的工业废水中含有大量的Fe2+、SO42-和较多的Cu2+及少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和 括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实 验方案。

(1)操作②的名称为__________,所需要的玻璃仪器为__________、玻璃棒、烧杯。
(2)试剂⑤的化学式为__________,发生化学反应的离子方程式为__________。
(3)为验证溶液⑧中含有SO42-:取少量的溶液⑧于试管中,先加入____再加入__________,若观察到有白色沉淀,则说明溶液⑧中含有SO42-。写出上述反应的离子方程式______________________________.
-
某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
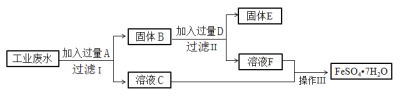
回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO4•7H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
-
某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。

回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:__________、______。
(3)得到FeSO4•7H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。

斗
c.玻璃棒 d.酒精灯
2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
2CuSO4 + 2H2O









