-
草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________; 假设二:全部是FeO ; 假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 | 若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:去步骤2得到少量固体与试管中,滴加 | |
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
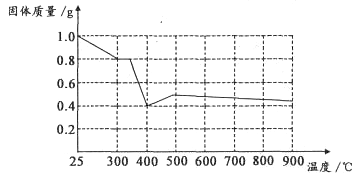
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。
-
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加 ________ | ________ |
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2 +3Mn
+3Mn +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2 )= ;FeC2O4 的质量分数为 (精确到0.01%)。
)= ;FeC2O4 的质量分数为 (精确到0.01%)。
-
草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有________。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L-1盐酸、3% H2O2、0.1 mol•L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g 样品中:n(Fe2+)=________; n(C2O42-)=________;FeC2O4 的质量分数为 ________(精确到0.01%,FeC2O4的式量为144)
-
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有 。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
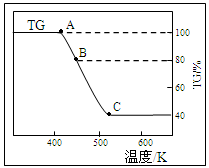
①试确定B点对应固体物质的化学式 ;
②写出B C对应的化学方程式 。
C对应的化学方程式 。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为 。
(3)在步骤②中,下列操作会引起测定结果偏高的是 。
A、滴定管在盛装高锰酸钾前未润洗
B、滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数
D、滴定前读数正确,滴定终点时仰视读数
(4)0.20g 样品中 FeC2O4 的质量分数为 。(不考虑步骤②中的损耗)
-
.(8分)草酸亚铁晶体(FeC2O4·2H2O)常用作分析试剂及显影剂等。下图是将一定质量的草酸亚铁在氩气氛围中进行热重分析的示意图(TG%表示残留固体质量占原样品质量的百分数)。请回答下列问题:

(1)B处残留物的化学式为________。C处残留物的化学式为________。
(2)A→C整个反应过程中总反应的化学方程式为________。
(3)上述FeC2O4·2H2O在氩气气氛中进行热重分析的原因是________。
若将分解得到的600℃时的固体与足量的浓硫酸反应后,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为。
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s) + CO(g)  Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为________。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为________。
-
草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
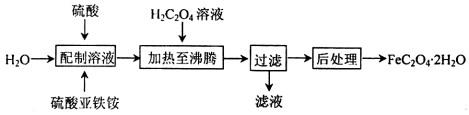
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是_______________。
(2)加热到沸腾时发生反应的化学方程式为______________________。
(3)向盛有草酸亚铁品体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。已知反应中MnO4-转化为无色的Mn2+,则该过程中被氧化的元素是_________。若反应中消耗l mol FeC2O4·2H2O,则参加反应的n(KMnO4)=____________。
(4)草酸亚铁品体在氩气气氛中进行热重分析,结果如下图所示(TG%表示残留固体质 量占原样品总质量的百分数),请回答下列问题:
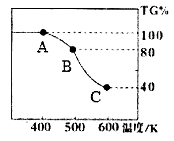
①A→B发生反应的化学方程式为________________。
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是_______;释放第二种气体时的化学方程式为___________。
-
草酸亚铁(FeC2O4·nHO)溶解度冷水中0.22g,热水中0.026g,具有强还原性,常用作分析试剂及显影剂。某化学小组利用工业废铁屑设计如下装置制备草酸亚铁晶体。回答下列问题:
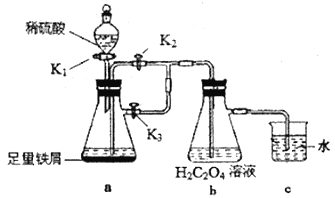
(1)实验前需将废铁屑在5%的Na2CO3溶液中加热并用蒸馏水洗涤干净,则Na2CO3溶液的作用是___________。
(2)组装好装置后首先需要检验装置的气密性,其方法是______________________。实验过程中装置c的作用是______________________。
(3)实验过程:在相应装置添加试剂后,需要让a瓶中反应先进行一段时间以排除空气,进行的操作是打开K1将一定量稀硫酸加入a瓶后关闭K1,同时还要进行的操作是___________,一段时间后,需要将a装置中的硫酸亚铁溶液导入装置b中,其操作是___________。
(4)b中生成的沉淀需过滤、洗涤、干燥,洗涤时最好选用下列试剂中的___________(填序号)。检验洗涤干净的方法是___________。
a.硫酸 b.冷水 c热水
(5)准确称取9g草酸亚铁晶体(FeC2O4·nH2O)于锥形瓶中,加入一定量硫酸溶解并加热至50℃,然后用1.0mol·L-1的KMnO4标准溶液滴定,达到滴定终点时用去30mL标准溶液。滴定反应为:10(FeC2O4·nH2O)+6KMnO4+24H2SO4=5Fe2(SO4)3+20CO2↑+6MnSO4+3K2SO4+(24+10n)H2O。
①判断滴定终点的依据为___________。②n=___________。
-
(20分)草酸亚铁和草酸铁常用作照相显影剂或制药工业。I.某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·2H2O)分解产物的实验探究。他们设计了如下装置进行实验(夹持装置未画出),干燥管B、G中装有无水氯化钙,试管D、F、I中盛有澄清石灰水。
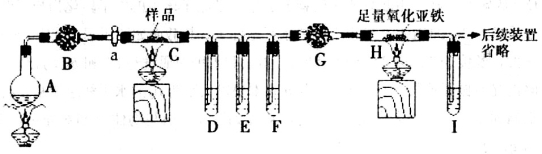
(1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,则该反应的化学方程式为_____________________________。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________。
(3)①试管D中出现浑浊,证明分解产物中有____________存在。
②证明分解产物中存在CO的现象是______________________________。
③要证明分解时产生的另一种气态产物的存在,应该如何改进装置______________。
④将C中充分反心后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为_____________(填化学式)。
II.三氯化铁是合成草酸铁的重要原料。已知草酸铁晶体在低温时溶解度较小。
(4)利用工业FeCl3(含杂质)制取纯净的草酸铁晶体【Fe2(C2O4)3·5H2O】的实验流程如下图所示:
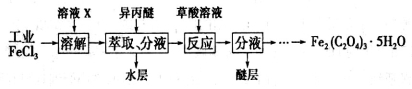
①溶液X为浓盐酸,目的是_________________。
②上述流程中FeCl3可用异内醚萃取,其原因是__________________。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是___________________。
④为测定所得草酸铁晶体的纯度,实验室中用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于__________(填“酸式”或“碱式”)滴定管中。
-
草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
| 操作 | 现象 | 结论与解释 |
| (1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
| (2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
| (3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
| (4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。
-
草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
| 操作 | 现象 | 结论与解释 |
| (1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
| (2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
| (3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
| (4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。







