-
草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
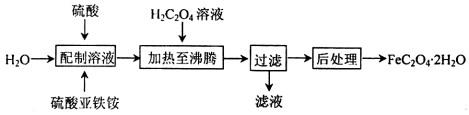
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是_______________。
(2)加热到沸腾时发生反应的化学方程式为______________________。
(3)向盛有草酸亚铁品体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。已知反应中MnO4-转化为无色的Mn2+,则该过程中被氧化的元素是_________。若反应中消耗l mol FeC2O4·2H2O,则参加反应的n(KMnO4)=____________。
(4)草酸亚铁品体在氩气气氛中进行热重分析,结果如下图所示(TG%表示残留固体质 量占原样品总质量的百分数),请回答下列问题:
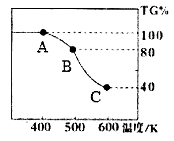
①A→B发生反应的化学方程式为________________。
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是_______;释放第二种气体时的化学方程式为___________。
-
草酸亚铁晶体(FeC2O4· 2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
① 称取硫酸亚铁铵晶体5 g,放入250 mL三颈烧瓶中,加入10滴左右1.0 mol·L-1 H2SO4溶液和15 mL蒸馏水加热溶解;
② 加入25 mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③ 待黄色晶体FeC2O4∙2H2O沉淀后倾析,洗涤,加入约20 mL蒸馏水搅拌并温热5 min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
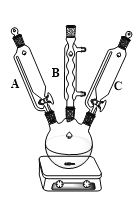
回答下列问题:
(1)仪器C的名称是_____________;仪器B的作用是_____________
(2) 硫酸亚铁铵晶体用硫酸溶解的原因是_____________________
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式___________________________________
II、探究草酸亚铁的纯度:
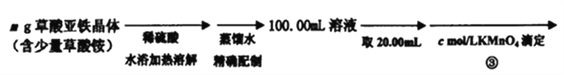
① 准确称取m g草酸亚铁固体样品(含有草酸铵杂质),溶于25 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液;
② 取上述溶液20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)滴定三次,平均消耗V1 mL;
③ 加入适量锌粉和2 mL 2 mol·L-1 H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④ 过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3 mL 2 mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,共平行测定三次,平均消耗V2 mL。
回答下列问题:
(4)在②中溶液中发生MnO4—+8H++5Fe2+==5Fe3++Mn2++4H2O ,还有另一氧化还原反应,写出其离子方程式_____________________________________,用KMnO4标准溶液滴定至终点的现象是________________________________________
(5)加入适量锌粉的目的是______________________________________;步骤③中检验其中微量的Fe3+的试剂名称是______________溶液
(6)计算m g固体样品的纯度为______________(用含c、V1、V2的式子表示,不必化简)
-
草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
Ⅰ、草酸亚铁晶体的制备:

(1)步骤①硫酸亚铁铵晶体加稀硫酸溶解的原因是___________________。
(2)步骤2倾析的作用是使固液分离,具体操作是静置后,将沉淀上部的溶液倾入另一容器,从而获得固体。倾析法与普通的过滤相比,明显的优点是____________________。
(3)硫酸亚铁铵俗称莫尔盐,在空气中比一般的亚铁盐稳定,较难被氧化,其水溶液的性质与组成它的简单盐的混合溶液没有区别。设计简单实验证明硫酸亚铁铵比硫酸亚铁更稳定______________________。
Ⅱ、测定草酸亚铁的纯度:
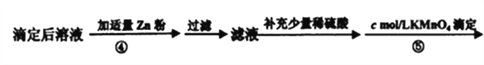
(4)在步骤③的溶液中除发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O 外,还有另一氧化还原反应,写出该反应的离子方程式__________________ ;用KmnO4标准溶液滴定至终点的现象是_____________________。
(5)步骤④加入适量锌粉的目的是________________。
(6)相同条件下,重复滴定三次,步骤③平均消耗KmnO4标准溶液V1mL,步骤⑤平均消耗V2mL,则mg固体样品的纯度计算式为______________。(用相关字母表示,不必化简)
-
草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:

(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
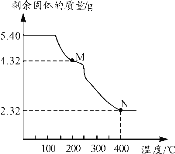
①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
-
草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
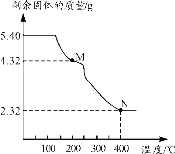
①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
-
草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:

(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
-
草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________; 假设二:全部是FeO ; 假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 | 若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:去步骤2得到少量固体与试管中,滴加 | |
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
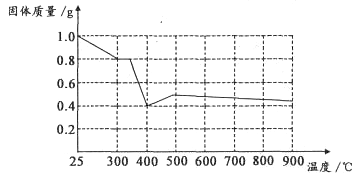
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。
-
草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
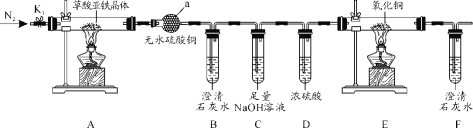
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
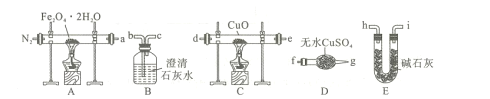
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
-
草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
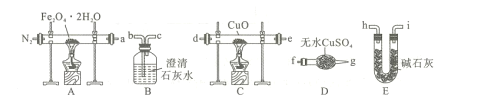
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
-
草酸亚铁晶体 是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
 称取硫酸亚铁铵晶体
称取硫酸亚铁铵晶体 ,放入
,放入 三颈烧瓶中,加入10滴左右
三颈烧瓶中,加入10滴左右 溶液和
溶液和 蒸馏水加热溶解;
蒸馏水加热溶解;
 加入
加入 饱和草酸溶液,加热搅拌至沸,停止加热,静置;
饱和草酸溶液,加热搅拌至沸,停止加热,静置;
 待黄色晶体
待黄色晶体 沉淀后倾析,洗涤,加入约
沉淀后倾析,洗涤,加入约 蒸馏水搅拌并温热
蒸馏水搅拌并温热 ,静置,弃去上层清液,即得黄色草酸亚铁晶体。
,静置,弃去上层清液,即得黄色草酸亚铁晶体。
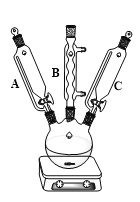
回答下列问题:
(1)仪器C的名称是_____________;仪器B的作用是_____________
(2)硫酸亚铁铵晶体用硫酸溶解的原因是 _____________________
II、探究草酸亚铁的纯度:
 准确称取
准确称取 草酸亚铁固体样品
草酸亚铁固体样品 含有草酸铵杂质
含有草酸铵杂质 ,溶于
,溶于 溶液中,在
溶液中,在 水浴加热,用
水浴加热,用 容量瓶配成
容量瓶配成 溶液;
溶液;
 取上述溶液
取上述溶液 ,用
,用 标准溶液
标准溶液 浓度为
浓度为 滴定三次,平均消耗
滴定三次,平均消耗 ;
;
 加入适量锌粉和
加入适量锌粉和 溶液,反应一段时间后,取1滴试液放在点滴板上检验,至
溶液,反应一段时间后,取1滴试液放在点滴板上检验,至 极微量;
极微量;
 过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约
过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约 溶液,继续用
溶液,继续用 标准溶液
标准溶液 浓度为
浓度为 滴定至终点,共平行测定三次,平均消耗
滴定至终点,共平行测定三次,平均消耗 。
。
回答下列问题:
(3)在 中溶液中发生
中溶液中发生 ,还有另一氧化还原反应,写出其离子方程式_______________________,用
,还有另一氧化还原反应,写出其离子方程式_______________________,用 标准溶液滴定至终点的现象是__________________。
标准溶液滴定至终点的现象是__________________。
(4)加入适量锌粉的目的是______________________________________;步骤 中检验其中微量的
中检验其中微量的 的试剂名称是______________溶液
的试剂名称是______________溶液
(5)计算 固体样品的纯度为______________
固体样品的纯度为______________ 用含c、
用含c、 、
、 的式子表示,不必化简
的式子表示,不必化简

















