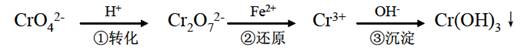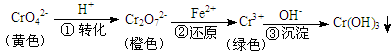-
工业上常用还原沉淀法处理含铬废水(Cr2 和Cr
和Cr ),其流程为:Cr
),其流程为:Cr
 Cr2
Cr2
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr (黄色)+2H+
(黄色)+2H+ Cr2
Cr2 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是( )
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr 浓度增大
浓度增大
B.步骤①中当2v(Cr )=v(Cr2
)=v(Cr2 )时,说明反应2Cr
)时,说明反应2Cr (黄色)+2H+
(黄色)+2H+ Cr2
Cr2 (橙色)+H2O达到平衡状态
(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O
,需要12 mol (NH4)2Fe(SO4)2·6H2O
D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽
-
工业上常用还原沉淀法处理含铬废水(Cr2 和Cr
和Cr ),其流为:
),其流为:
Cr
 Cr2
Cr2
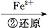 Cr3+
Cr3+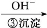 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr (黄色)+2H+
(黄色)+2H+ Cr2
Cr2 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr 浓度增大
浓度增大
B.步骤①中当2v(Cr )=v(Cr2
)=v(Cr2 )时,说明反应2Cr
)时,说明反应2Cr (黄色)+2H+
(黄色)+2H+  Cr2
Cr2 (橙色)+H2O达到平衡状态
(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O
,需要12 mol (NH4)2Fe(SO4)2·6H2O
D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽
-
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知: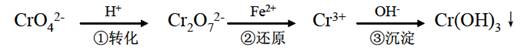
(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+ Cr2O42—(橙色)+H2O
Cr2O42—(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1 时可视作该离子不存在下列有关说法中,正确的是:( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O 达到平衡状态
Cr2O72—(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。
D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽
-
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
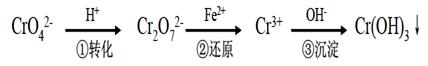
已知:(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在下列有关说法中,正确的是( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O 达到平衡状态
Cr2O72—(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。
D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽
-
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
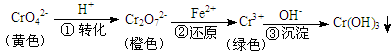
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32
Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32
下列有关说法不正确的是
A.步骤①中当v正(CrO42—) = 2v逆(Cr2O72—)时,说明反应:2CrO42—+2H+ Cr2O72—+H2O 达到平衡状态
Cr2O72—+H2O 达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原1 mol Cr2O72—离子,需要12 mol (NH4)2Fe(SO4)2
D.步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+) ≤10-5 mol/L时,可视作该离子沉淀完全)
-
工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为
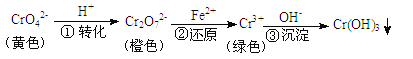
步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)∙c3(OH-)=10-32,下列有关说法正确的是
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)∙c3(OH-)=10-32,下列有关说法正确的是
A.步骤①中当v(CrO42-)=2v(Cr2O72-)时,说明反应:2CrO42-+2H+  Cr2O72- +H2O达到平衡状态
Cr2O72- +H2O达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由黄色变橙色
C.步骤②中,若要还原1 mol Cr2O72- 离子,需要12 mol的Fe2+
D.步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽
-
工业上常用还原沉淀法处理含铬废水( 和
和 ),其流程为:
),其流程为:
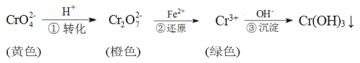
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)Ksp=c(Cr3+)·c3(OH-)=10-32
下列有关说法正确的是( )
A.步骤①中当2v正( )=v逆(
)=v逆( )时,说明反应:2
)时,说明反应:2 +2H+⇌
+2H+⇌ +H2O达到平衡状态
+H2O达到平衡状态
B. 在酸性溶液中不能大量存在
在酸性溶液中不能大量存在
C.步骤②中,若要还原1mol 离子,需要12mol(NH4)2Fe(SO4)2
离子,需要12mol(NH4)2Fe(SO4)2
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全)
-
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法为还原沉淀法,该法的工艺流程为CrO42-Cr2O72-Cr3+Cr(OH)3↓。
其中第①步存在平衡2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要 mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为 。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程): 。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程): 。
-
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为

其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
-
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72-和CrO42-工业废水的一种常用方法,其工艺流程为:

其中第Ⅰ步存在平衡:2Cr2O42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=0,该溶液显__________色。
②根据 2Cr2O42-(黄色)+2H+ Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
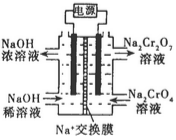
③第Ⅱ步反应的离子方程式:_________________________。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:

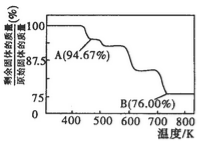
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是____________(填化学式)。
和Cr
),其流程为:Cr
 Cr2
Cr2 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(黄色)+2H+
Cr2
(橙色)+H2O
Cr3+(aq)+3OH-(aq)
浓度增大
)=v(Cr2
)时,说明反应2Cr
(黄色)+2H+
Cr2
(橙色)+H2O达到平衡状态
,需要12 mol (NH4)2Fe(SO4)2·6H2O
 Cr2
Cr2 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓