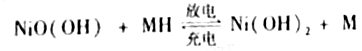-
(15分)开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。
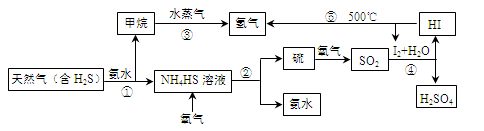
回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3 天然气理论上可制得氢气 m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)

-
开发氢能是实现社会可持续发展的需要.硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2.
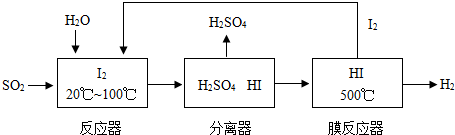
请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______.
(2)该循环工艺过程的总反应方程式为______.
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是______.
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池.电池充放电时的总反应为:NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为______.
②充电完成时,Ni(OH)2全部转化为NiO(OH).若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为______.
-
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
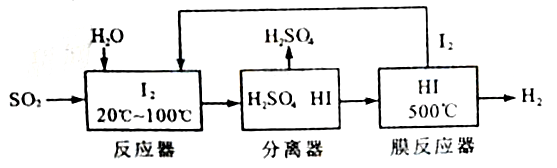
请回答下列问题:
(1)已知1gFeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
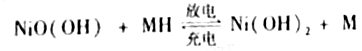
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为______________
-
随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
Ⅰ.(1)生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式: 。
(2)热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
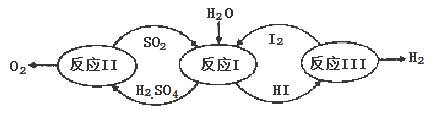
请回答下列问题;
①该循环工艺过程的总反应方程式为 .
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是 。
(3)最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是 (填“催化剂”或“中间产物”),若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为 。
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是 .
Ⅱ.(4)氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX ,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix 的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixH6+6NiO(OH)  LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为: 。
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为: 。

-
硫化氢是天然气及石油中含硫杂质,近年来发现H2S可用于高效制取氢气。回答下列问题:
(1)H2S可用FeCl3溶液、NaClO溶液及氨水等吸收。
①FeCl3溶液吸收H2S气体,该反应的还原产物为_________。
②NaClO溶液吸收H2S,氧化剂与还原剂的物质的量之比为4:1,则该反应的离子方程式
为___________。
(2) Linkkous等学者通过多硫化物作循环液,设计出如下四步反应:
(Ⅰ)H2S+OH-=HS-+H2O (Ⅱ)2HS-+H2O H2↑+S22-
H2↑+S22-
(Ⅲ)H2S+S22-=2HS-+S↓ (Ⅳ)HS-+H2O=H2S+OH-
四步反应的总反应的化学方程式为__________________;能量转化方式为______。
(3)克劳斯法脱硫包含的反应为:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1
2H2S(g)+ SO2(g)=3S(s)+ 2H2O(l) △H2
H2S(g)+  O2(g)= S(s)+ 2H2O(l) △H3
O2(g)= S(s)+ 2H2O(l) △H3
①△H3=_________(用△H1、△H2表示)。
②为了达到较好的脱硫率,除采用多级脱硫外,还可采取的措施是___________________。
(4)硫化氢裂解制氢气的反应为2H2S(g)  S2 (g)+2H2 (g),设起始时容器中只有H2S,平衡时三种物质的组成与裂解温度关系如图所示。
S2 (g)+2H2 (g),设起始时容器中只有H2S,平衡时三种物质的组成与裂解温度关系如图所示。
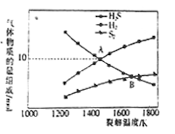
①A点时,H2S的转化率为_______________。
②B点时,设容器的总压为p Pa,则平衡常数Kp为________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
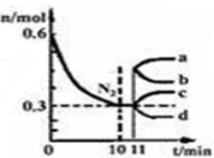
(1)氢气也可以作为化工生产的原料,如一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
(2)在工业上也可以利用氢气合成液体燃料。如:工业上合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
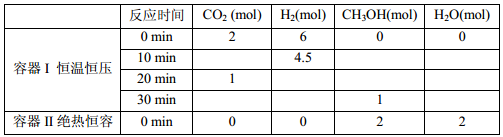
达到平衡时,反应I、II对比:平衡常数K(I)_______K(II)(填“>”“<”或“=”)。保持其他条件不变的情况下,若30 min时只向容器I中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。
(3) 100 kPa时,绝热密闭容器中发生反应2NO(g)+O2 (g) 2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
: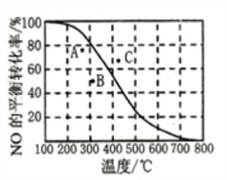
300℃时,VmL NO和0.5mLO2混合发生该反应,最终混合气体的平均摩尔质量为: _________(用含V的计算式表示)。图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则_____点对应的压强最大。若氧气中混有氮气,容器中还同时发生了如下反应N2(g)+O2(g)  2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
-
合成氨的流程示意图如下:
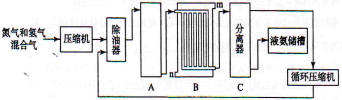
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是 ,其中发生的化学反应方程式为 ;
(3)设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因是 ;
(4)设备C的作用是 ;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过以下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中的c(H2O):c(CO)不低于 。
-
氢气是21世纪极有前途的新型能源,是各国研究的热点之一.氢能开发的首要问题是研究如何以水为原料制取氢气.以下研究方向中你认为可行的是
A. 大量建设水电站,用电力分解水制取氢气
B. 设法将太阳能聚焦,产生高温,使水分解产生氢气
C. 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气
D. 寻找更多的活泼金属,与水发生置换反应,不断从水中制取氢气
-
[化学——物质结构与性质](13分)
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
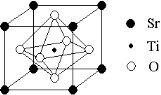
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
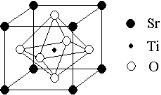
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
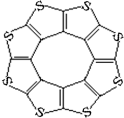
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
-
[化学——物质结构与性质](13分)
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ 氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ 氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
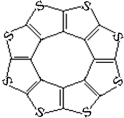
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。

CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
×100%,计算结果保留小数点后1位)