-
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
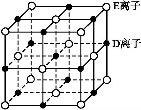
(6)已知 DE 晶体的晶胞如图所示:
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
-
R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___ (填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______ (填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
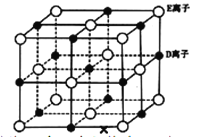
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1 pm=1. 0×10-12 m)。
-
R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___ (填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______ (填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1 pm=1. 0×10-12 m)。

-
选修3——物质结构与性质]
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子的电子排布式为_____________,其第一电离能比Z元素原子的第一电离能________(填“高”或“低”)
(2)X的氯化物的熔点比Q的氯化物的熔点_______________(填“高”或“低”),理由是___________________
(3)光谱证实元素W的单质与强碱性溶液反应有W(OH)4]-生成,则W(OH)4]-中存在_______(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
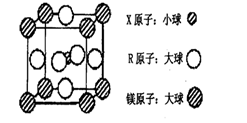
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_________;晶体中每个镁原子周围距离最近的R原子有___________个。
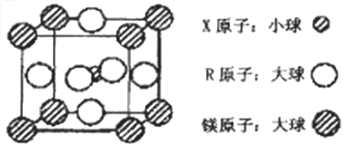
-
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
-
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
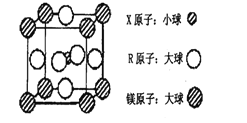
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
-
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:l1=578KJ•mo1-1;l2=1817KJ•mo1-1;l3=2745KJ•mo1-1;
l4=11575KJ•mo1-1 ;l5=14830KJ•mo1-1 ;l6=18376KJ•mo1-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子的电子排布式为______;其第一电离能比Z元素原子的第一电离能______(填“高”或“低”).
(2)X的氯化物的熔点比Q的氯化物的熔点______(填“高”或“低”),理由
是______.
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)______.
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
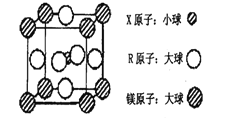
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示.则该晶体的化学式为______;晶体中每个镁原子周围距离最近的R原子有______个.
-
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
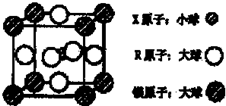
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为________;晶体中每个镁原子周围距离最近的R原子有________个。
-
(12分)X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称) ,X3Z+的VSEPR模型名称是 。
(2)M基态原子的电子排布式是 ;
(3)R的单质为面心立方最密堆积(见下图),则一个晶胞中R原子数为 ,R的配位数是 。
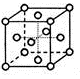
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是 .
-
X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称)_____,X3Z+的VSEPR模型名称是______。
(2)M基态原子的电子排布式是______________。
(3)R的单质为面心立方最密堆积(见图),则一个晶胞中R原子数为 ,R的配位数是 。
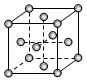
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是_________________。