-
在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)( )
A.9 B.13 C.11~13之间 D.9~11之间
-
(11分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)25℃时,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),①________和________两种粒子的物质的量之和等于0.1mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是________,上述离子浓度大小顺序关系中正确的是(选填序号)________。
②若上述关系中C是正确的,则溶液中溶质的化学式是 ________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前________c (HCl)(填“>”、“<”、或“=”,下同)c(NH3·H2O).
混合后溶液中与c(NH4+)c(Cl-)。
-
(12分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)________。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①________和________两种粒子的物质的量之和等于0.1mol。
②________和________两种粒子的物质的量之和比OH―多0.05mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是________,上述离子浓度大小顺序关系中正确的是(选填序号)。
②若上述关系中C是正确的,则溶液中溶质的化学式是________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)________c(Cl-)。
-
(7分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为________(填序号)。
A.9 B.13 C.11~13之间 D.9~11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
________c(CH3COO-)(填“>”、“=”或“<”)。
(3)常温下,已知某NH4Cl溶液中的c(NH4+)=c(Cl一),则该溶液的pH________7(填“>”、“=”或“<”)。
(4)如果将HCl和CH3COONa溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为________
-
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)________.
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)________.
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①________和________两种粒子的物质的量之和等于0.1mol.
②________和________两种粒子的物质的量之和比OH-多0.05mol.
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是________,上述离子浓度大小顺序关系中正确的是(选填序号)________.
②若上述关系中C是正确的,则溶液中溶质的化学式是________.
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)________c,混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)________c(Cl-).
-
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________。
A.氨水与氯化铵发生化学反应; B.氯化铵溶液水解显酸性,增加了c(H+);
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小;
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①___________、___________和___________三种粒子的物质的量之和等于0.1mol。
②___________和___________两种粒子的物质的量之和比OH―多0.05mol。
-
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________。
A.氨水与氯化铵发生化学反应; B.氯化铵溶液水解显酸性,增加了c(H+);
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小;
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①___________、___________和___________三种粒子的物质的量之和等于0.1mol。
②___________和___________两种粒子的物质的量之和比OH―多0.05mol。
-
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
【答案】 D C 氯化铵 A NH4Cl和HCl < = NH3•H2O NH4+ NH4+ H+
【解析】(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1%,溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,故答案为:C;
(3)①因任何水溶液中都有OH−、H+,若溶质只有一种则为NH4Cl,因NH4+水解,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH−),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合。故答案为:氯化铵;A;
②C中离子关系可知溶液显酸性,且c(Cl−)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl。故答案为:NH4Cl和HCl;
③NH4Cl是强酸弱碱盐其水溶液呈酸性,盐酸与氨水混合,要溶液呈中性,则氨水应稍微过量,所以n(HCl)<n(NH3·H2O)。因为盐酸和氨水的体积相等,则c(HCl)<c(NH3·H2O)。溶液呈中性,则c(H+)=c(OH−),溶液呈电中性,所以溶液c(NH4+)=c(Cl-)。
故答案为:<,=。
(3)根据N原子守恒可知,溶液中NH3•H2O和NH4+两种粒子的物质的量之和等于0.1mol,故答案为:NH3•H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol。
故答案为:NH4+;H+.
【题型】综合题
【结束】
25
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________;
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式________________________.
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为________________ (已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
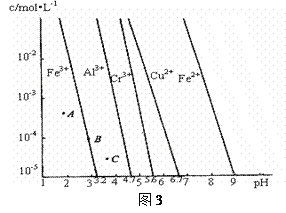
①相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是_______,图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是______________。
②由图可得Fe(OH)2的溶度积的值为__________________________。
-
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
-
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
【答案】 D C 氯化铵 A NH4Cl和HCl < = NH3•H2O NH4+ NH4+ H+
【解析】(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1%,溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,故答案为:C;
(3)①因任何水溶液中都有OH−、H+,若溶质只有一种则为NH4Cl,因NH4+水解,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH−),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合。故答案为:氯化铵;A;
②C中离子关系可知溶液显酸性,且c(Cl−)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl。故答案为:NH4Cl和HCl;
③NH4Cl是强酸弱碱盐其水溶液呈酸性,盐酸与氨水混合,要溶液呈中性,则氨水应稍微过量,所以n(HCl)<n(NH3·H2O)。因为盐酸和氨水的体积相等,则c(HCl)<c(NH3·H2O)。溶液呈中性,则c(H+)=c(OH−),溶液呈电中性,所以溶液c(NH4+)=c(Cl-)。
故答案为:<,=。
(3)根据N原子守恒可知,溶液中NH3•H2O和NH4+两种粒子的物质的量之和等于0.1mol,故答案为:NH3•H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol。
故答案为:NH4+;H+.
【题型】综合题
【结束】
25
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________;
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式________________________.
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为________________ (已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
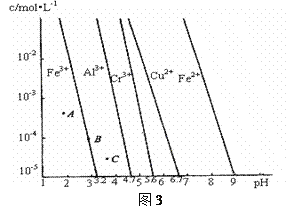
①相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是_______,图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是______________。
②由图可得Fe(OH)2的溶度积的值为__________________________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。

