-
(1)0.1mol/LNa2CO3溶液呈________(填“酸性”、“碱性”或“中性”),其原因是________(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式.请写出氢氧燃料(电解质溶液为KOH溶液)的负极的电极反应式________.
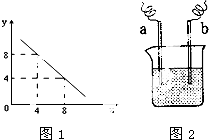
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-ymol/L.x与y的关系如图1所示:该温度下水的离子积为________;该温度下0.01mol/L NaOH溶液的pH为________.
(4)如图2装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+
该装置中原电解质溶液一定含有________ (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)⇌Ba 2+ (aq)+SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0-10,在0.1mol•L一1硫酸溶液中,钡离子的浓度最大可达到________mol•L一1.
-
(1)0.1mol/L Na2CO3溶液呈 ________(填“酸性”、“碱性”或“中性”),其原因是 ________(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式________。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:
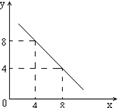
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu
b极:Fe-2e-= Fe2+
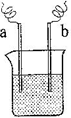
该装置中原电解质溶液一定含有________ (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到________mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到________mol·L一1
-
(1)0.1mol/L Na2CO3溶液呈 ________(填“酸性”、“碱性”或“中性”),其原因是 ________(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式________。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:
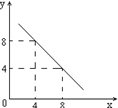
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu
b极:Fe-2e-= Fe2+
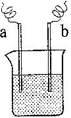
该装置中原电解质溶液一定含有________ (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到________mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到________mol·L一1
-
(1)0.1mol/L Na2CO3溶液呈 ________(填“酸性”、“碱性”或“中性”),其原因是________(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式________;
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为________;该温度下0.01 mol/L NaOH溶液的pH为________。

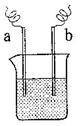
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有________;(填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到________mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到________mol·L一1。
-
在48mL 0.1mo/LHNO3溶液中加入12mL 0.4mol/LKOH溶液时,所得到的溶液( )
A.弱酸性
B.强酸性
C.碱性
D.中性
-
下列说法中正确的是( )
A.在25℃时,无论是酸性、碱性还是中性溶液中,其c(H+)和c(OH-)乘积都等于1×10-14
B.0.1mol/LNaOH溶液和0.1mol/L 氨水中,其c(OH-)相等
C.pH为3 的盐酸中,其c(H+)是pH为1 的盐酸中的3 倍
D.在Na2CO3溶液中,c(Na+)/c(CO32-)=2/1
-
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=1g 。则下列叙述不正确的是
。则下列叙述不正确的是
A.中性溶液的AG=0
B.碱性溶液的AG>0
C.AG越大碱性越强,酸性越弱
D.常温下0.1mol·L-1氢氧化钠溶液的AG=-12
-
常温下,下列有关离子浓度之间的关系不正确的是( )
A.将CO2通入0.1mol/LNa2CO3溶液至中性(忽略溶液体积变化),溶液中:2c(CO32-)+c(HCO3-)=0.2mol/L
B.在0.1mol/LNaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO42-)
C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后pH=5,则混合溶液中:c(Na+)>c(CH3COO-)
D.已知Ka(CH3COOH)=Kb(NH3·H2O),则常温下0.1mol/LCH3COONH4中:c(CH3COO-)=c(NH4+)
-
(1)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB- H++B2-。Na2B溶液显________(填“酸性”“中性”或“碱性”);已知0.1mol/L NaHB溶液的pH=2,则0.1mol/L H2B溶液中氢离子的物质的量浓度可能是____________0.11mol/L(填“<”、“>”、“=”)理由是:___________;
H++B2-。Na2B溶液显________(填“酸性”“中性”或“碱性”);已知0.1mol/L NaHB溶液的pH=2,则0.1mol/L H2B溶液中氢离子的物质的量浓度可能是____________0.11mol/L(填“<”、“>”、“=”)理由是:___________;
(2)某温度时,水的离子积为Kw=1×10-12,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=____________;
(3)25℃时,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则反应后溶液中溶质为_________________;用含a的代数式表示NH3·H2O的电离平衡常数Kb=________________。
(4)已知CH3COOH酸性强于HCN,一定温度下,等体积、等物质的量浓度为CH3COONa和NaCN两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1___________n2(填“>”、“<”或“=”)。
-
25℃某溶液中c(OH-)=1×10-14 mol·L-1,满足此条件的溶液可能是( )溶液
A. 酸性 B. 碱性 C. 酸性或碱性 D. 中性





