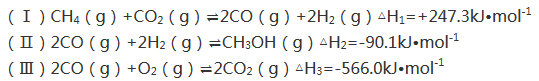-
由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
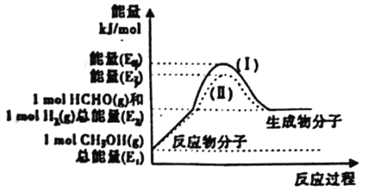
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程Ⅱ(填“大 于”、“小于”或“等于”)。
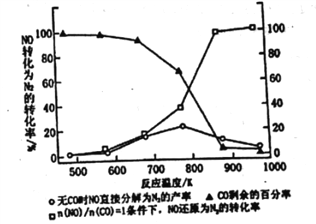
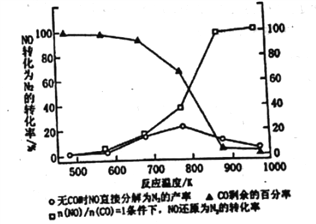
Ⅱ.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2,则该反应的ΔH_________0(填“>”、“<”或“=”);
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
-
由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g) +1/2O2(g) =CO(g) +2H2(g)△H1=-36kJ·mol-1
2CH4(g) +H2O(g) =CO(g) +3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
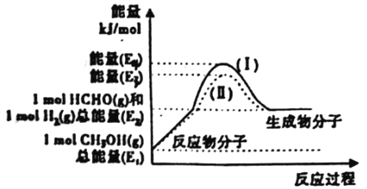
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II (填“大 于”、“小于”或“等于”)。
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃ 和T2℃时,测得各物质平衡时物质的量(n/mol) 如下表:
| 物质 温度℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2,则该反应的ΔH_________0 (填“>”、“<”或“=”) ;
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
-
(18分)甲醇是一种重要的化工原料,在生产中有着重要应用。工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应(下列焓变数据均在25℃测得):
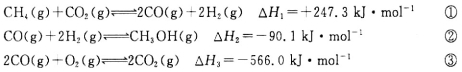
(1)25℃时,用CH4和O2直接制备甲醇蒸气的热化学方程式为________________;
(2)某温度下,向容积为4 L的恒容密闭容器中通入6 molCO2和6 mol CH4,发生反应①,5 min后反应在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5 min内的平均反应速率v(CO)=________mol·L-1·min-1;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数________(填“增大”“不变”或“减小”);
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,25℃时,其反应的热化学方程式为:
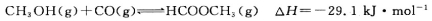
科研人员对该反应进行了研究,部分研究结果如下图所示:
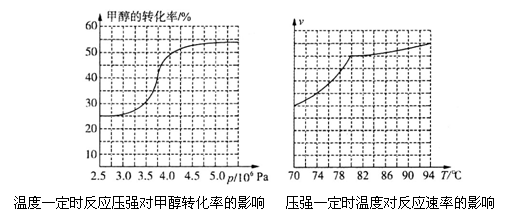
①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸甲酯应选择的是_______(填下列序号字母)
a.3.5×106Pa b.4.0×l06Pa c.5.0×106Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是______________
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
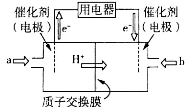
①通入气体a的电极是电池的_____(填“正”或“负”)极,其电极反应式为__________;
②25℃时,用此电池以石墨作电极电解0.5 L饱和食盐水(足量),若两极生成的气体共1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液体积的变化)。
-
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
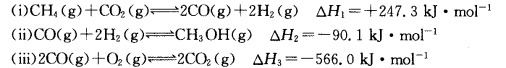
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
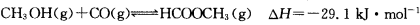 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
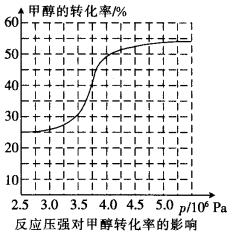
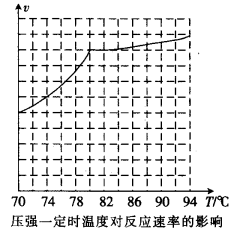
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
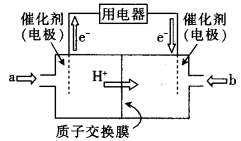
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
-
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
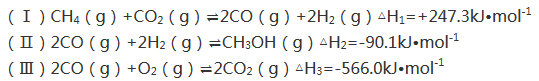
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向容积为4 L的容器通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反 应”或“逆反应”)方向移动。
应”或“逆反应”)方向移动。
-
(本题共14分)元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
51.某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为 g/mol。
52.39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为 mol,金属A的相对原子质量为 。
53.由NaCl、NaHCO3、Na2CO3·10H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为 ,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P) L。
54.将一包铝热剂(铝粉和氧化铁的混合物)进行如下实验
①向一份铝热剂中加入800mL 2.0mol/L的NaOH溶液,使其充分反应后,收集到的气体体积为20.16L(S.T.P)。
②另一份等质量的铝热剂在高温下充分反应后,向反应后固体中加入2L 2.5mol/L的盐酸溶液,使固体完全溶解,反应后溶液pH=0(假设过程中溶液体积不变),取少量反应后溶液,滴加硫氰化钾,没有出现血红色。完成下列计算:
(1)计算该铝热剂中铝与氧化铁物质的量之比。
(2)实验②产生的气体体积是多少(S.T.P)?
-
元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
(1)某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为__g/mol.
(2)39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为__mol,金属A的相对原子质量为__.
(3)由NaCl、NaHCO3、Na2CO3•10H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为___,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)__L.
-
元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
(1)某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为__g/mol.
(2)39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为__mol,金属A的相对原子质量为__.
(3)由NaCl、NaHCO3、Na2CO3•10H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为___,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)__L.
-
硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
②1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H = - 47.3kJ•mol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJ•mol-1
反应CaO(s)+3CO(g)+SO2(g)  CaS(s)+3CO2(g) △H= kJ•mol-1;
CaS(s)+3CO2(g) △H= kJ•mol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
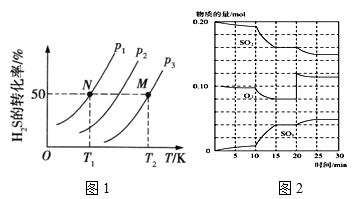
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
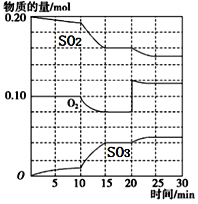
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
-
硫单质及其化合物在工农生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=_____________kJ·mol-1
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。
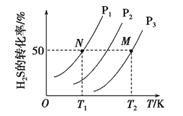
该反应平衡常数的大小关系为K(T1) ____K(T2)(填“>”、“=”或“<”),理由是____。用各物质的平衡分压代替平衡浓度表示反应的平衡常数,记为Kp,计算该反应在T1温度下的Kp=_________(用p1表示)。
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)  2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。




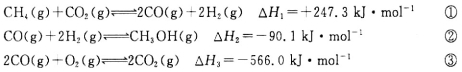
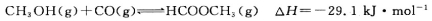


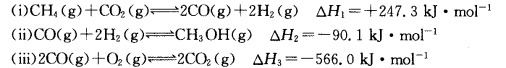
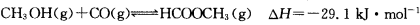 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下: