-
(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是________,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =________。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是________。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)该反应的温度控制在1300-1700oC的原因是。
(4)某温度下,测得该反应中N2和CO各个时刻的浓度如下,则0—20 min内N2的平均
反应速率________,在平衡混合气体中CO的体积分数是________。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度 /mol·L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度 /mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
-
(16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =________。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 ________。
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 ________。
A.升高温度 B.降低压
C.加入更多的SiO2 D.充入N2
(4) 某温度下,测得该反应中N2和CO各个时刻的浓度如下,
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1[ | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
求0—20 min内N2的平均反应速率V(N2 )=________ ,该温度下,反应的平衡常数K=________。
-
(16分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是________,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =________。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是________。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率________ ,该温度下,反应的平衡常数K=________。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | | | |
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是________,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =________。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强
C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率________ ,该温度下,反应的平衡常数K=________。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
-
碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)  Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
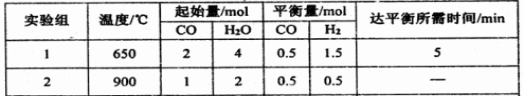
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
① 实验1中,前5min的反应速率v(CO2)= 。
②下列能判断实验2已经达到平衡状态的是 。
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO) =v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
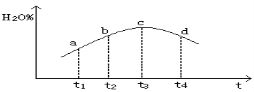
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示, b点v正 v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。
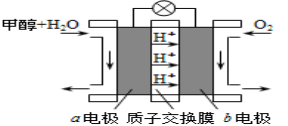
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
-
碳、氮广泛地分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
(2)某研究小组现将三组CO(g) 与H2O(g) 的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),得到下表数据:
CO2(g) + H2(g),得到下表数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min |
| CO | H2O | CO | H2 |
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
| | | | | | |
① 实验1中,前5min的反应速率v(CO2) = 。
② 下列能判断实验2已经达到平衡状态的是 (填序号)。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③ 若实验2的容器是绝热的密闭容器,实验测得H2O(g) 的转化率ω(H2O)随时间变化的示意图如图1所示,b点v正 v逆(填“<”、“=”或 “>”),t3~t4时刻,H2O(g) 的转化率ω(H2O)降低的原因是 。
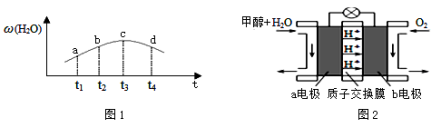
(3)利用CO与H2可直接合成甲醇,上图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol·L-1的CuSO4溶液,当电池消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
-
氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述正确的
A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
B.上述反应中每生成1molSi3N4,N2得到12mol电子
C.若已知上述反应为放热反应,升高温度,其平衡常数增大
D.若使压强增大,上述平衡向正反应方向移动
-
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
________SiO2+________C+________N2 ________Si3N4+________CO
________Si3N4+________CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内)
(2)该反应中的氧化剂是________,其还原产物是________;
(3)该反应的平衡常数表达式为K=________;
(4)若知上述反应为放热反应,则其反应热为△H________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”)
(5)若使压强增大,则上述平衡向________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/则N2的消耗速率为v(N2)=________mol/.
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:________SiO2 + ________C + ________N2 ________Si3N4 + ________CO
________Si3N4 + ________CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是________。
(3)分析反应可推测碳、氮气的氧化性:C________N2(填“>”“<”“=”)。
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:________SiO2 + ________C + ________N2 ________Si3N4 + ________CO
________Si3N4 + ________CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是________。
(3)分析反应可推测碳、氮气的氧化性:C________N2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是。
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
Si3N4(s)+6CO(g)



