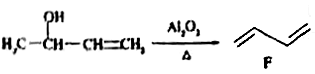-
工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法.下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 |
| 乙炔 | CaCO3 CaO CaO CaC2 CaC2 C2H2 C2H2 |
| 乙烯 | 来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因.
从表一看:______
从表二看:______
(2)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定).若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
-
(10分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 |
| 乙炔 | 
|
| 乙烯 | 来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
___________________________________________________________________。
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率_______(填增大、减小、不变);而实际生产中不采用的理由是_____________________________。
(5)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
-
下列关于有机物的说法正确的是
A. 乙烯水化生成乙醇属于取代反应
B. 乙醇与酸性高锰酸钾溶液反应生成乙醛
C. 油脂在碱性条件下的水解反应,常用来制取肥皂
D. 硝酸可以使蛋白质变黄,能用来鉴别所有的蛋白质
-
钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
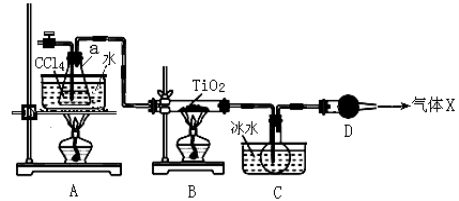
下表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
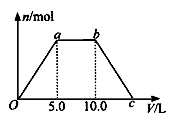
⑤ 若将反应过程中生成的气体X(足 量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
-
下列说法不正确的是( )
A. 以淀粉为主要原料可制取乙酸乙酯
B. 用氢氧化钠溶液无法鉴别矿物油和植物油
C. 某烷烃的二氯代物有3 种,则该烃的分子中碳原子个数可能是4
D. 乙烯、乙炔、乙醇、乙醛、葡萄糖都能与酸性的KMnO4或K2Cr4O7溶液反应
-
乙二醛(OHC-CHO)是一种重要的精细化工产品。
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
2H2(g)+O2(g) 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
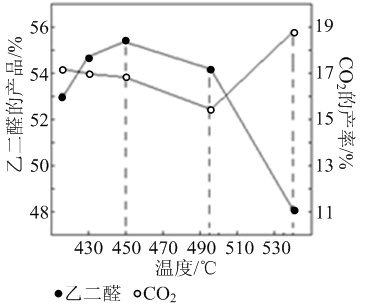
② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2 与乙二醛溶液反应生成乙醛酸。
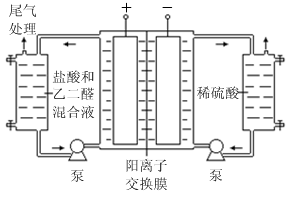
(3)阴极电极式为
(4)阳极液中盐酸的作用,除了产生氯气外,还有
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=
(设:法拉第常数为f C·mol-1;η= )
)
-
乙二醛(OHC—CHO)是一种重要的精细化工产品。
Ⅰ. 工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC—CHO(g) +2H2(g) HOCH2CH2OH(g) △H=−78kJ·mol−1 K1
HOCH2CH2OH(g) △H=−78kJ·mol−1 K1
2H2(g) + O2(g) 2H2O(g) △H=−484kJ·mol−1 K2
2H2O(g) △H=−484kJ·mol−1 K2
乙二醇气相氧化反应HOCH2CH2OH(g) +O2(g) OHC—CHO(g) + 2H2O(g)的△H= kJ·mol−1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g) + 2H2O(g)的△H= kJ·mol−1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、 。
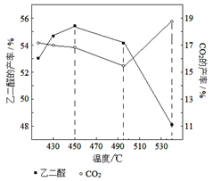
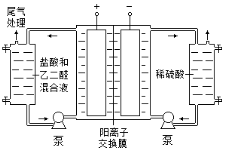
Ⅱ. 乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
(3)阴极反应式为 。
(4)阳极液中盐酸的作用,除了产生氯气外,还有 。
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η= 。(设:法拉第常数为f C•mol−1;η= )
)
-
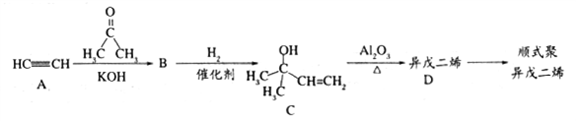
乙炔是一种重要的工业原料,由它制备人造橡胶——顺式聚异戊二烯的一种合成路线如下:
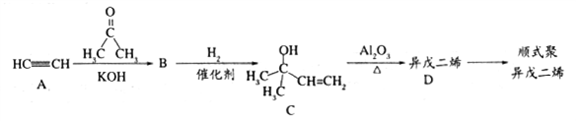
已知:在一定条件下可发生下列反应:
①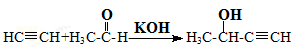 E
E
②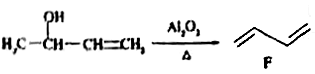
(1)乙醛的核磁共振氢谱中有______种峰,峰面积之比为_______。
(2)题给信息中反应②的反应类型是_____________。
(3)C中含氧官能团的名称是_______,D的系统命名法的名称是______。
(4)D分子中最多______个原子共面。
(5)下列物质能与E发生化学反应的是_______(填编号)。
a.溴水 b.酸性高锰酸钾 c.乙酸
(6)写出A→B的化学方程式_______。
(7)写出D生成顺式聚异戊二烯的化学方程式______________。
(8)写出与A物质具有相同官能团的异戊二烯的三种同分异构体结构简式_______、______、______。
-
乙炔是一种重要的工业原料,由它制备人造橡胶——顺式聚异戊二烯的一种合成路线如下:
已知:在一定条件下可发生下列反应:
①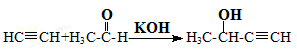 E
E
②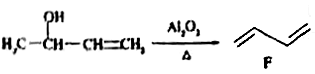
(1)乙醛的核磁共振氢谱中有______种峰,峰面积之比为_______。
(2)题给信息中反应②的反应类型是_____________。
(3)C中含氧官能团的名称是_______,D的系统命名法的名称是______。
(4)D分子中最多______个原子共面。
(5)下列物质能与E发生化学反应的是_______(填编号)。
a.溴水 b.酸性高锰酸钾 c.乙酸
(6)写出A→B的化学方程式_______。
(7)写出D生成顺式聚异戊二烯的化学方程式______________。
(8)写出与A物质具有相同官能团的异戊二烯的三种同分异构体结构简式_______、______、______。
-
下列可以用于工业上制备酒精的方法是( )
A.淀粉发酵 B.乙酸乙酯水解
C.乙烯水化 D.乙醛加氢




 )
)

 )
)
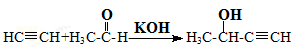 E
E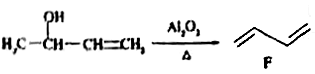

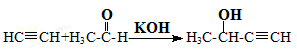 E
E