-
(14分)氯化硫酰(SO2Cl2)是一种无色液体,遇水剧烈水解,其熔点为-54.1 ℃,沸点为69.1 ℃,可用作氯化剂及锂电池正极活性物质。氯化硫酰可用下列反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3 kJ/mol。
SO2Cl2(l) △H=-97.3 kJ/mol。
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写): 。
a.缩小容器体积 b.使用催化剂 c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为: 。
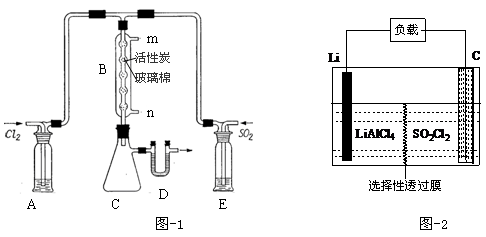
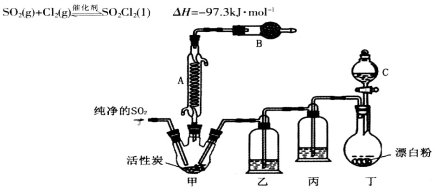
(3)某同学设计了下图所示装置制取氯化硫酰:
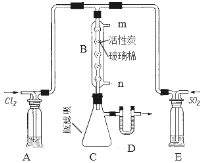
①有关该装置的说法正确的是(用字母编号填写): 。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是: 。
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为______,分离产物的方法是: 。
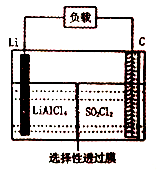
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:_______________________。

-
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾。
(1)SO2Cl2水解的方程式为_______________________________________________
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
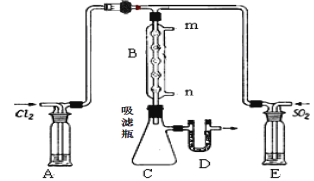
①E中所用的试剂为________________
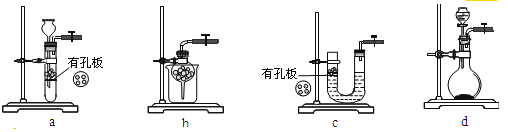
②实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是____(选填编号);检查该装置气密性的操作是:关闭止水夹,再___________________________________
③B处反应管内五球中玻璃棉上的活性炭的作用为:_______________________D处U形管中盛放的试剂为_________________,作用 :________________________
(3)已知:以下三个反应的反应热,a、b、c均为正值
①SO2(g)+Cl2(g)+SCl2(g)  2SOCl2(g) △H=-akJ·mol-1
2SOCl2(g) △H=-akJ·mol-1
②SO2Cl2(g)+SCl2(g)  2SOCl2(g) △H=-bkJ·mol-1
2SOCl2(g) △H=-bkJ·mol-1
③SO2Cl2(l)  SO2Cl2(g) △H= + ckJ·mol-1
SO2Cl2(g) △H= + ckJ·mol-1
则反应:SO2(g)+Cl2(g)  SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
-
(10分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)磺酰氯可与白磷发生反应为:P4 + 10 SO2Cl2 = 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。
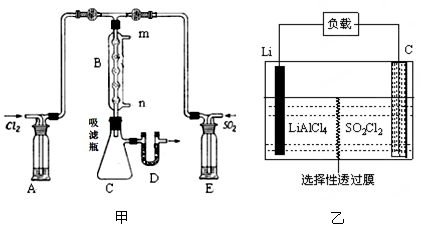
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为 。
②有关题图甲所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.D处U形管中盛放的可以是碱石灰
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(3)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li + SO2Cl2 = 2LiCl + SO2↑,则电池工作时,正极的电极反应式为 。
-
(14分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:①SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) △H=a kJ·mol-1
2SOCl2 (g) △H=a kJ·mol-1
②SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2 (g)
(g) SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
(2)磺酰氯可与白磷发生反应为:P4 + 10 SO2Cl2 = 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
①若用浓盐酸与二氧化锰为原料制取Cl2,其 反应的化学方程式为 。
反应的化学方程式为 。
②有关图-1所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U 形管中盛放的可能是碱石灰
形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图-2所示,已知电池反应为:2Li + SO2Cl2 = 2LiCl + SO2↑;则电池工作时,正极的电极反应式为 。
-
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是________(用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为________。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为________。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
-
硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
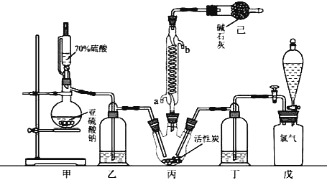
回答下列问题:
(1)装置己的作用是_________________________________________________;如何控制两种反应物体积相等:__________________________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_____(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 mol·L−1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫会发生副反应,化学方程式是________________________________________________________;同时生成的SO2Cl2也会水解而“发烟”,该反应的化学方程式为______________________________________
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)______。
①控制气流速率,宜慢不宜快 ②持续加热丙装置
③若丙装置发烫,可适当降温 ④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H SO2Cl2 + H2SO4,分离两种产物的方法是__________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是__________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
请设计实验方案检验产物中存在硫酸(可选试剂:稀盐酸、稀硝酸、氯化钡溶液、蒸馏水、石蕊试液)_______________________________________________________________________。
-
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)
 SO2Cl2(l)△H=-97.3kJ/mol
SO2Cl2(l)△H=-97.3kJ/mol
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是______(用编号填空).
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)已知20℃时,AgCl的溶解度为0.00015g,Ag2SO4的溶解度为0.796g.则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
(3)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g,则300℃的合成SO2Cl2反应的平衡常数为______.
(4)将(3)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量(写出计算过程)______.
-
已知磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。磺酰氯(SO2Cl2)的制备方法及装置图如下:SO2(g)+Cl2(g) SO2C12(g)
SO2C12(g)  H<0,
H<0,
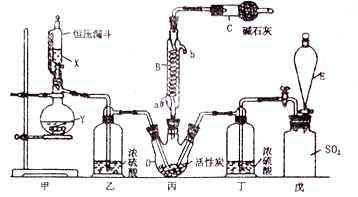
(1)化合物SO2Cl2中S元素的化合价是 。
(2)仪器D的名称是 ,仪器C的作用除了吸收氯气和二氧化硫,还具有 作用。
(3)戊是贮气装置,则E中的溶液是 ;若缺少装置乙和丁,则产物变质,发生反应的化学方程式是
(4)反应结束后,将丙中混合物分离开的实验操作是 。
(5)有关该实验叙述正确的是
a、X、Y最好的席间组合是铜片和浓硫酸
b、活性炭的作用是作催化剂
c、冷凝管B也可以用作蒸馏
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为: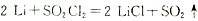 ,则电池工作时,正极的电极反应式为是
,则电池工作时,正极的电极反应式为是
-
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
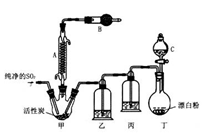
回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是________。
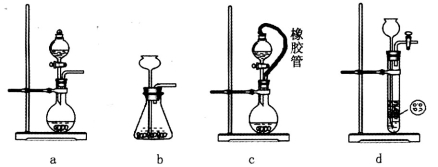
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
-
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,已知:SO2(g)+Cl2(g) SO2Cl2(l) △H=﹣97.3kJ/mol,实验室合成反应和实验装置如图所示:
SO2Cl2(l) △H=﹣97.3kJ/mol,实验室合成反应和实验装置如图所示:
回答下列问题:
(1)仪器A的名称为_________,活性炭的作用是 B中加入的药品是_________。实验时从仪器C中放出溶液的操作方法是_________ 。
(2)装置丁中发生反应的离子方程式为_________ __。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。

(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_____ 。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_ 。
SO2Cl2(l) △H=-97.3 kJ/mol。







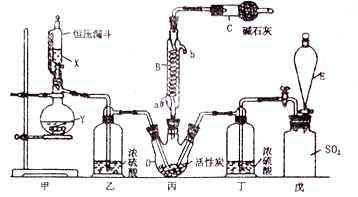
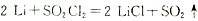 ,则电池工作时,正极的电极反应式为是
,则电池工作时,正极的电极反应式为是



