-
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
| NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
(1)117g食盐理论上可以制取纯碱________g;
(2)45℃反应完毕后,有晶体析出;溶液中剩余水________g,析出晶体的质量________g。
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量共________克
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
| b∕a的取值范围 | 溶质 | 溶质物质的量 |
| | |
| 
| —— | —— |
| | |
| | |
-
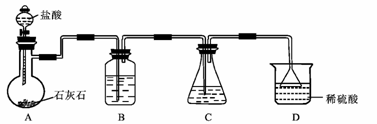
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。
请回答下列问题:
(1)装置的连接顺序是:(a)接(____)(____)接(____)(b)接(_____)

(2)A中常选用的固体反应物为___________;D中应选用的液体为__________;B中发生反应的化学方程式为____________________________________。
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是__________________________,C中广口瓶内产生固体的总化学方程式为____________________________。
(5)第四步中分离出NH4Cl晶体的操作是_____________;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象_______________________。
-
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水

四种盐在不同温度下的溶解度(g/100g水)表
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是________(填字母)。
(2)A装置中盛放的试剂是________,其作用是________。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是________。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去________杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有________(以化学式表示),加入氯化氢,并进行________操作,使NaCl溶液循环使用,同时可回收NH4C1。
-
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气和二氧化碳为原料制得NaHCO3,进而生产出纯碱。
Ⅰ.某研究性学习小组的同学,模拟“侯氏制碱法”提出下列一种制备NaHCO3 的实验方案,经过讨论,大家一致认为方案2较合理,请说明方案3的不足之处是__________。
方案1:分别将二氧化碳和氨气通入NaCl饱和溶液中;
方案2:将二氧化碳通入含氨的NaCl饱和溶液中;
方案3:将氨气通入含二氧化碳的NaCl饱和溶液中。
Ⅱ.根据方案2,某同学设计了如下实验步骤和装置图:
步骤1:配制含氨的饱和食盐水。在100mL的锥形瓶中加人20mL氨水(体积比 1︰ 1),再加入 8g 食盐, 塞紧橡皮塞, 振荡几分钟, 过滤除去不溶物, 得到含氨的饱和食盐水。
步骤2: 制备碳酸氢钠。 按图组装实验装置,先检查装置的气密性,再向各仪器中加入相应的试剂,开始制备碳酸氢钠。 实验过程中,需要控制温度在30℃~35℃(大于35℃时NH4HCO3会分解) 和二氧化碳的通入速度(以出现能数得清的连续气泡为好)。反应结束后,把锥形瓶浸入冷水中,使较多的晶体析出,过滤、洗涤。
请回答下列问题:
(1)D烧杯中稀硫酸的作用是_________。
(2)装置B中试剂是_______, 它的作用为________。
(3)装置C中的化学方程式为______。
(4)检验步骤2中所得晶体是碳酸氢钠而不是氯化钠的的实验方法和现象是_____。 (5)为了检验某含有NaHCO3,杂质的Na2CO3样品的纯度,现将m1 g 样品加热,其质量变为m2 g,则样品的纯度是_________.
-
(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
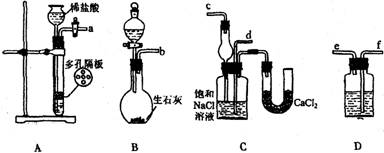
(2)A中常选用的固体反应物为____________;D中应选用的液体为___________ (填化学式)
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________,C中广口瓶内产生固体的总化学方程式为________。
(5)在第四步中分离NH4Cl晶体的操作是________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分中含有Na+。简要写出操作和现象________。
-
(14分)“侯氏制碱法”是我国著名的工业化学家侯德榜发明的,该制碱法为中国化学工业乃至世界化学工业做出了重要的贡献。请回答以下问题:
(1)为了验证NaHCO3和Na2CO3的稳定性,设计了如图的实验装置(铁架台、夹持仪器、加热装置等已省略):

在Y中应放的物质是 (填化学式)。
(2)某化学研究性学习小组以NH3、CO2、饱和食盐水为原料,模拟侯德榜先生制碱原理设计了下图的实验装置。
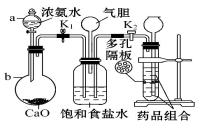
①写出对应仪器的名称:a ,b 。
②实验的操作步骤中,打开旋塞K1、K2的合理顺序为:先打开 ,后打开 (填字母代号)。理由是 。
③利用该装置制得的NaHCO3将采用 (填实验操作)分离;
装置中气胆的作用是 。
(3)实验室欲配制500mL0.1 mol·L-1NaHCO3溶液。
①配制溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
②下列情况会造成所配溶液的浓度偏低的是
a.加水时超过刻度线 b.容量瓶内壁附有水珠而未干燥处理
c.未洗涤烧杯和玻璃棒 d.定容时俯视刻度线
-
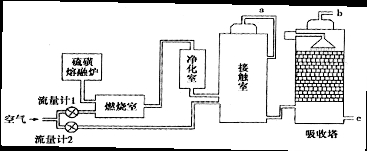
【化学选修2:化学与技术】(15分)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:
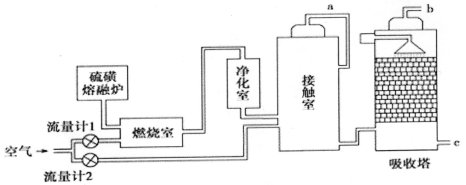
请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面_ (可多选)
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(2)为充分利用反应放出的热量,接触室中应安装______ (填设备名称)。吸收塔中填充有许多瓷管,其作用是 .
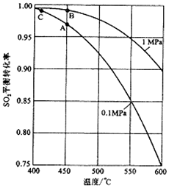
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃ ,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是_______ ; 。

(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是 。
-
中航工业成都飞机工业(集团)有限责任公司为中国航空事业做出了巨大贡献,先后研制了歼5、歼教5、歼7、歼教7、歼10、枭龙等歼击机和教练机。银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极电极反应式为 ;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,将红棕色气体溶于水的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)配平煅烧过程中一个反应的化学方程式:
CuO + Al2O3  CuAlO2 + ↑
CuAlO2 + ↑
(4)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
(5)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol/L的Al2(SO4)3溶液 L。
-
火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面 。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(2)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃ ,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ; 。
(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是 。
-
火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:

请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面_ (可多选)
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(2)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 .
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃ ,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ; 。

(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是 。
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:












