-
(10分)
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
N2+2CO2。
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为:
K=。
(2)已知:CO(g)+ O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol
N2(g)+O2(g)=2 NO(g) △H=+180 kJ/mol
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=________kJ/mol。
N2(g)+2CO2(g)△H=________kJ/mol。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是________。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是________。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是________
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成NaCO3的物质的量为________mol。
-
汽车尾气中含有CO和氮氧化物.治理尾气的方法是在排气管上安一个催化转化器,其中发生如下反应:2NO+2CO⇌N2+2CO2.
(1)2NO(g)+2CO(g)⇌N2(g)+2CO2(g)反应的平衡常数的表达式为:K=______.
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=______kJ/mol.
(3)对于可逆反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是______.
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是______.
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为______mol.
-
近年来,汽车尾气催化净化成为极其重要的环保产业。请回答下列问题:
I.治理汽车尾气中NO和CO的一种方法是在汽车的排气管道上安装一个催化转化装置。发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
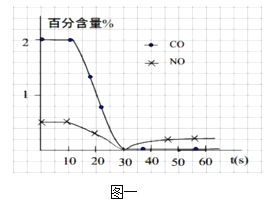
(1)实际测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如图一,0~10 s阶段,CO、NO百分含量没有明显变化的原因是______;
(2)在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图二。
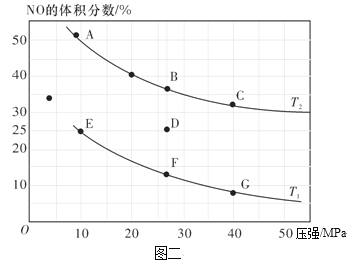
①已知T2>T1,则反应2NO(g)+2CO(g) N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
②为同时提高反应速率和NO的平衡转化率,可采取的措施有______(填字母序号)。
a.改用高效催化剂 b.缩小容器的体积
c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,该温度下用分压表示的平衡常数Kp=___MPa-1(分压=总压×物质的量分数)。
II.汽车尾气中CO与N2O会发生反应:N2O(g)+CO(g) CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量/ kJ/mol | 475.5 | 283 | 0 | 393.5 |
(3)ΔH=___kJ/mol。
(4)实验室用Fe+作催化剂,以N2O和CO投入比为1:1模拟上述反应,其总反应分两步进行:
第一步:Fe++N2O FeO++N2;
FeO++N2;
第二步:___(写反应方程式)。
催化过程中,c(N2)和c(CO2)几乎相等,由此判断该反应进行的快慢由第___步反应决定。
请在如图中绘制反应在催化剂作用下的“能量~反应过程”示意图___。已知:两步反应均放热。

-
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知反应中相关键能数据如下:
| 化学键 | C O O | N O O | N | C=O |
| 键能/kJ·mol-1 | 1076 | 632 | 946 | 750 |
(1)由此计算△H=__________。
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
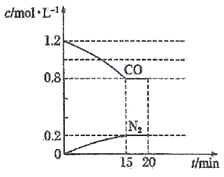
①有害气体NO的转化率为__________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是__________ (填序号)。
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③ 若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将__________ (填“正向” 或“逆向”)移动。
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
(3)该法可能发生副反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ,减少副反应的主要措施是___________(写一条即可)。
4NO(g)+6H2O(g) ,减少副反应的主要措施是___________(写一条即可)。
(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
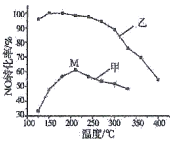
①工业上选择催化剂__________(填“甲”或“乙”),原因是____________。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______ (填“可能是”、“一定是”或“一定不是”) 该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)
-
汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管安装“催化转化装置器”。它能使CO和NOx反应生成可参与大气生态环境循环的无毒气体,并使烃类充分燃烧、SO2转化。下列说法中正确的是( )
A.CO和NOx反应的化学方程式为2xCO+2NOx===2xCO2+N2
B.上述方法的缺点是导致空气中CO2的含量增大,从而大大提高空气的酸度
C.植树造林,增大绿化面积,能从根本上控制城市的各种污染源
D.汽车改用天然气或氢气作为燃料,不会减少对空气的污染
-
汽车尾气(含烃类、CO、NO与SO2等)是城市空气主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0.下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
-
(5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)若升高温度,则该反应的平衡常数________ (填“增大”、“减小”或“不变”).
(3)判断该条件下反应(填能、不能)自发.
-
汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用如图所示装置模汽车尾气处理中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
 CO↑+H2O)
CO↑+H2O)
试回答下列问题:
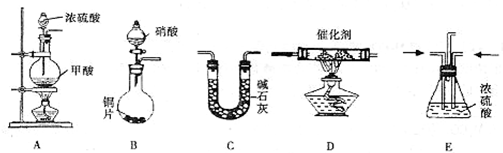
(1)仪器的连接顺序为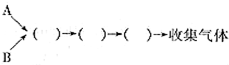
(2)E装置的作用是______、______.
(3)写出D中的NOX与CO反应的化学方程式______
-
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源.治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的氧化.
写出NO分别与CO、SO2反应的化学方程式:______ 2CO2+N2
-
(11分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:
________________________________________________________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是______________。
(3)控制城市空气污染源的方法可以有___________________________________(填字母序号)。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
N2+2CO2。
N2(g)+2CO2(g)反应的平衡常数的表达式为:
O2(g)=2CO2(g) △H=一283 kJ/mol
N2(g)+2CO2(g)△H=________kJ/mol。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是________。