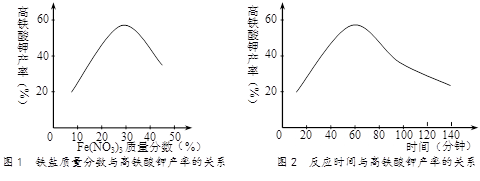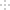-
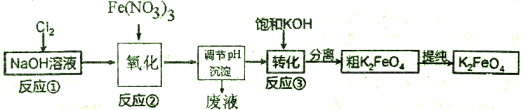
(14分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

(1)在农业生产中,滤液1可用作▲ 。
(2)上述氧化过程中,发生反应的离子方程式是:▲ ,控制反应温度30℃以下的原因是:▲ 。
(3)结晶过程中加入浓KOH溶液的作用是:▲ 。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为▲ 。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在▲ 附近、反应时间应控制在▲ 。

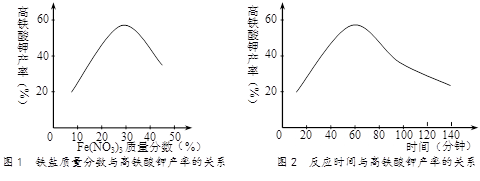
-
铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,高铁酸盐在碱性环境中比酸性环境中相对稳定。工业上用湿法制备高铁酸钾的基本流程如下图所示:
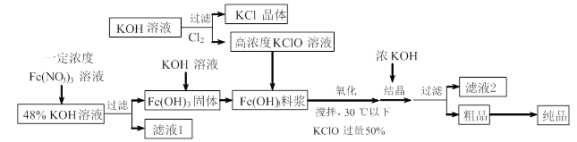
下列有关说法不正确的是
A.控制反应温度30℃以下的原因是防止生成的K2FeO4发生分解
B.结晶过程中加入浓KOH溶液其作用是增大K+浓度,促进K2FeO4晶体析出
C.滤液2中阳离子可通过焰色反应检验确定
D.湿法制备高铁酸钾,也可以在Fe(OH)3料浆中直接通入足量氯气
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,不会造成二次污染。
己知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
(1)①上述氧化过程中,发生反应的离子方程式是__________,在实际生产中一般控制反应温度30℃以下,其原因是__________。
②沉淀过程中加入浓KOH溶液可析出高铁酸钾(K2FeO4 ),这说明__________。
③在提纯K2FeO4中采用重结晶、洗涤、低温烘干的方法,沉淀洗涤方法是__________。
④某温度下,将C12通入NaOH溶液中,反应后得到NaCl,NaC1O,NaClO3的混合溶液,经测定ClO-与C1O3-离子的物质的量之比是1: 2,则C12与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为__________。
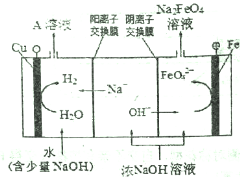
(2)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为__________,其中可循环使用的物质是__________。

(3)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。

25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3②HNO3③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,容易分解,工业上制备高铁酸钾的基本流程如下图所示:
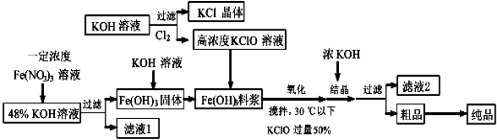
(1)K2FeO4中铁化合价为 在农业生产中,滤液1可用作。
(2)氧化过程中搅拌目的是 由粗品到纯品的实验方法是
(3)上述Fe(OH)3浆料中加入KClO溶液进行氧化过程中,发生反应的离子方程式是:,控制反应温度30℃ 以下的原因是: 。
(4)结晶过程中加入浓KOH溶液的作用是: 。
(5)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-与C lO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
lO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
-
(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
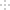
①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
-
(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
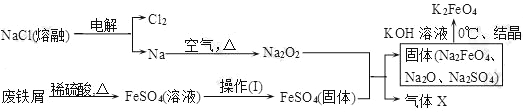
①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
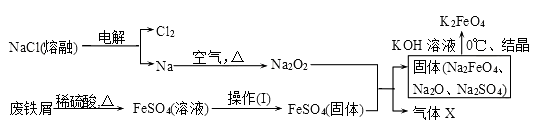
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。

(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
①湿法制备的主要反应方程式为:Fe(OH)3+ ClO—+ OH— → FeO42—+ Cl—+ H2O
②干法制备的主要反应方程式为: FeSO4+ Na2O2→ Na2FeO4+ Na2O+ Na2SO4 + O2↑
(均未配平)
下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法制备的反应方程式中,氧化剂和还原剂的物质的量之比为3∶2
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
①湿法制备的主要反应方程式为:Fe(OH)3+ ClO—+ OH— → FeO42—+ Cl—+ H2O
②干法制备的主要反应方程式为: FeSO4+ Na2O2 → Na2FeO4+ Na2O+ Na2SO4 + O2↑
(均未配平)
下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法制备的反应方程式中,氧化剂和还原剂的物质的量之比为3∶2
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质