-
煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g)  CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲,乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如图所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积(L) | 0.5 | 0.5 | V |
| 温度(℃) | T1 | T2 | T3 |
| 起始量 | 1molCO2(g) 2molCH3OH(g) | 1molDMC(g) 1molH2O(g) | 2molCO2(g) 2molCH3OH(g) |
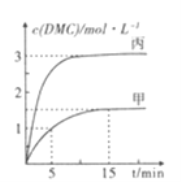
甲容器中,在5-15min时的平均反应速率v(CO2)=___________.乙容器中,若平衡时n(CO2)=0.2mol.则T1_____T2 (填“>”“<”或“=”)。两容器的反应达平衡时CO2的转化率: 甲________丙(填“>”“<."或”=”)。
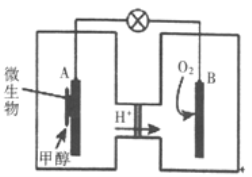
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示: A极是_____极(填“正”或“负”),其电极反应式是_______。该电池不能在高温下工作的理由是________。
-
煤的主要组成元素是碳、氢、氧、硫、氮,还有极少量的磷、砷、锗、镓、铟等元素,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)锗是第四周期第ⅣA族元素,其原子结构示意图为_______________________。
(2)利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:H2O(l)=H2O(g) △H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol
写出由CO 与 H2制备 CH3OH 气体的热化学方程式___________________________________。
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC) :
2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=_________________________。
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是_____________(填标号)。
A.v正(CH3OH)= 2v逆(H2O) B.容器内气体的密度不变
C.容器内压强不变 D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲、乙丙个恒容密团容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量依度随时间变化如下图所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积(L) | 0.5 | 0.5 | V |
| 温度(℃) | T1 | T2 | T1 |
| 起始量 | 1molCO2(g)2molCH3OH(g) | 1molDMC(g)1mol H2O (g) | 2molCO2(g)2molCH3OH(g) |
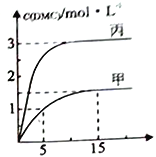
甲容器中,在5-15min中的平均反应速率v(CO2) =_____________。乙容器中,若平衡时n(CO2) =0.2mol,则T1________T2(填“>”“<"或”=”)。甲、丙两容器的反应达平衡时CO2的转化率:甲________丙(填“>”“<"或”=”)。
(4)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡_________移动(填“向左” “向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中 =____________。SO2可用足量小苏打溶液吸收,反应的离子方程式是_________________________________。(已知该温度下,H2SO3的电离常数:K1=4.5×10-2,K2=2.5×10-7,H2CO3的电离常数K1=8.4×10-7,K2=1.2×10-10)
=____________。SO2可用足量小苏打溶液吸收,反应的离子方程式是_________________________________。(已知该温度下,H2SO3的电离常数:K1=4.5×10-2,K2=2.5×10-7,H2CO3的电离常数K1=8.4×10-7,K2=1.2×10-10)
-
大气污染物主要成分是SO2、NO2、CxHy及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气。
(1)上述成分中能形成酸雨的是________(填化学式)。
(2)煤的气化是高效、清洁利用煤炭的重要途径之一。利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:CO2(g) + 3H2(g) =CH3OH(g) + H2O(g) ΔH 1 = − 58.7 kJ·mol-1
CO2(g) + H2(g) =CO(g) + H2O(g) ΔH 2 = + 41.0 kJ·mol-1
CO 与 H2 生成 CH3OH 气体反应的热化学方程式是___________。
(3)空气质子交换法治理SO2,其原理是将含有SO2的烟气与O2通过电化学反应制得硫酸,负极的电极反应式是___________。
(4)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐。反应的离子方程式是___________。
(5)用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒。烟气经下列过程可获得化肥。
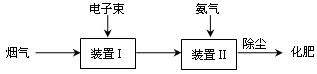
该化肥中含有的离子是______________(填离子符号)。
-
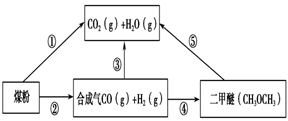
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:

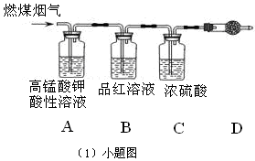
(1)用图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)
B中预期的实验现象是______,D中的试剂是______.
(2)已知C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是______,该反应的化学平衡常数K随温度的升高将______ (填“增大”、“减小”或“不变”).
(3)用图装置可以完成⑤的转化,同时提高能量的利用率.其实现的能量转化形式主要是______,a的电极反应式是______.

(4)燃煤烟气中的CO2可用稀氨水捕获和吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵.假设该方法每小时处理含CO2的体积分数为11.2%的燃煤烟气1000m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵______kg.
-
(15分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题。煤综合利用的一种途径如下所示:

(1)用如图[(1)小题图]所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)B中预期的实验现象是 ,D中的试剂是 。

(2)已知① C(s) + H2O(g) = CO(g) + H2 (g) ; ΔH1 = +131.3 kJ·mol-1
② C(s) + 2H2O(g) = CO2(g) + 2H2(g) ;ΔH2 = +90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)用(3)小题图装置可以完成⑤的转化,同时提高能量的利用率。其实现的能量转化形式主要是由 能转化为 能,a的电极反应式是 。
(4)燃煤烟气中的CO2可用稀氨水吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵。假设该方 法每小时处理含CO2的体积分数为11.2%的燃煤烟气 1000 m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵 kg。
-
(14分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:

(1)用下图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2),B中预 期的实验现象是 。

(2)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ•mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填
“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。

(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

-
煤的主要组成元素是碳、氢、氧、硫、氮,还有极少量的磷、砷、锗、镓、铟等元素, 燃煤产生CxHy、SO2、NOX等大气污染物,研究NO2、NO、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)锗是第四周期第ⅣA元素,其原子结构示意图为_______________。
(2)利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:H2O(l)=H2O(g) △H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol
写出由CO与H2制备CH3OH气体的热化学方程式_________________。
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC):
2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g) △H4<0
CH3OCOOCH3(g)+H2O(g) △H4<0
①该化学反应的平衡常数表达式为K=________________。
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是_______(填标号)。
A.v正(CH3OH)= 2v逆(H2O) B.容器内气体的密度不变
C.容器内压强不变 D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如下图所示:

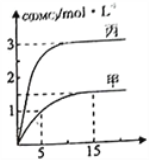
甲容器中,在5-15min中的平均反应速率v(CO2) =__________。乙容器中,若平衡时n(CO2) =0.2mol,则T1__________T2(填“>”“<"或”=”)。甲、丙两容器的反应达平衡时CO2的转化率:甲__________丙(填“>”“<"或”=”)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(ⅰ)与溶液pH的关系如图所示。
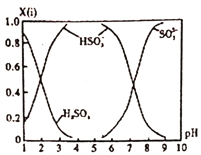
①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是__________________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_________________________________。
-
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。
(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。
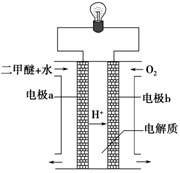
(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
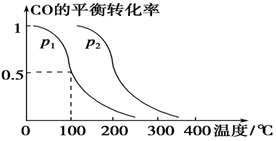
①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)  CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:
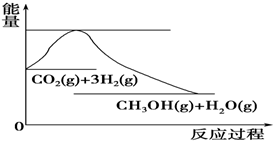
关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
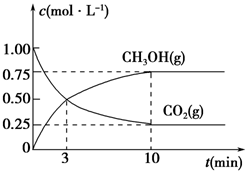
①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
-
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。
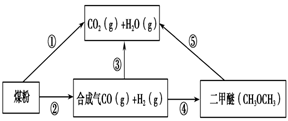
(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。
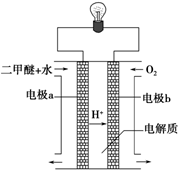
(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
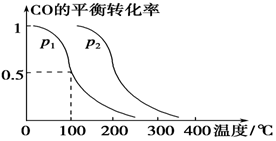
①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)  CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:
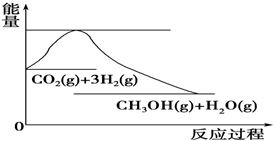
关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
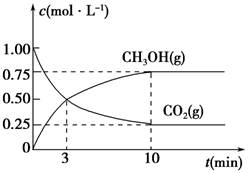
①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
-
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。
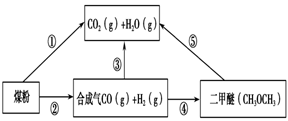
(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。
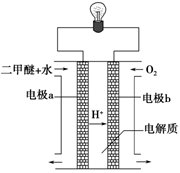
(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
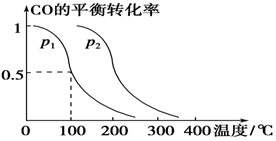
①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)  CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:
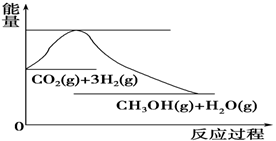
关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
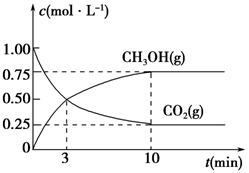
①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
CH3OCOOCH3(g)+H2O(g) ΔH4<0































