-
氮的固定是几百年来科学家一直研究的课题。请回答下列问题:
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2 (g)+O2 (g) 2NO(g) 2NO(g) | 工业固氮 N2 (g)+3H2 (g) 2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于 ________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因是 ________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 ________。
(2)已知工业固氮反应:N2(g)+ 3H2(g) 2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。

①在2L容器中发生反应,前20min内,ν(NH3) = ________。
②25 min时采取的某种措施是 ________。
③时段III条件下反应的平衡常数为 ________ L2· mol-2(保留3位有效数字) 。
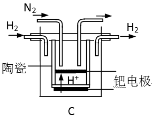
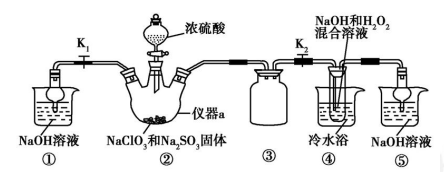
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如图2所示,阴极的电极反应式是 ________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l) 4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g) 2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g) 2H2O(l) ΔH2 =-571.6kJ·mol-1
2H2O(l) ΔH2 =-571.6kJ·mol-1
-
(13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2 (g)+O2 (g) 2NO(g) 2NO(g) | 工业固氮 N2 (g)+3H2 (g) 2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
| | | | | |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
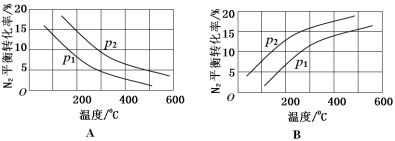
 (2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。
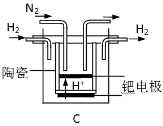
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是_____________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
-
(14分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g) 2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2 (g) 2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
| | | | | |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是 。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
-
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
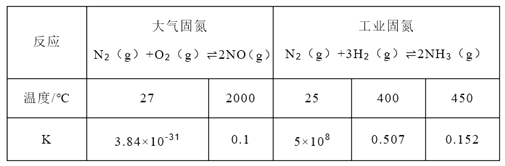
①分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因_________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因____________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系________,理由____________。
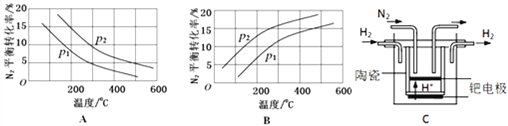
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l) 4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g) 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
-
Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | 工业固氮N2(g)+3H2(g)⇌2NH3(g) |
| 温度/℃ | 27 | 2 000 | 25 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:____________________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较p1、p2的大小关系:________。
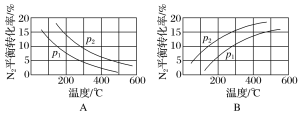
Ⅱ.目前工业合成氨的原理是N2(g)+3H2(g)⇌2NH3(g)。
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α1=________。
②已知平衡时,容器压强为8 MPa,则平衡常Kp=________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
-
氮的固定以及利用氨合成其他含氮化合物是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g) 2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1 |
| 温度/℃ | 27 | 2 000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于____________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因______________________________________。
③在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,如图所示的图示中,正确的是___________(填“A”或“B”);比较p1、p2的大小关系:___________。
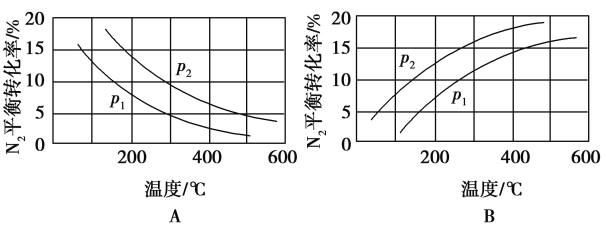
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生工业合成氨反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α1=_____________。
②已知平衡时,容器压强为8MPa,则平衡常数Kp=_________________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为提高H2的转化率,实际生产中宜采取的措施有______________(填字母)。
A.降低温度 B.最适合催化剂活性的适当高温 C.适当增大压强
D.减小压强 E.循环利用和不断补充氮气 F.及时移出氨
-
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2 (g)+O2 (g) 2NO(g) 2NO(g) | 工业固氮 N2 (g)+3H2 (g) 2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
| | | | | |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
 (2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。
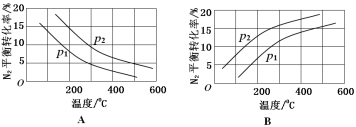

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是 。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1
2H2O(l) △H=-571.6kJ·mol-1
-
Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮N2(g)+O2(g) 2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g) 2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
| | | | | |
①分析数据可知:大气固氮反应属于____________(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因____________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是____________(填“A”或“B”);比较p1、p2的大小关系:____________。

Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(3) 在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1= ____________。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=____________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
(1)氮的固定是几百年来科学家一直研究的课题 。
下表列举了不冋温度下大气固氮和工业固氮的部分化学平衡常数K的值:
| 反应 | 大气固氮N2(g)+O2(g) 2NO(g) 2NO(g) | 工业固氮N2(g)+3H2 (g) 2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000℃ | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 200 |
①分析数据可知:大气固氮反应属于_____________ (填“吸热”或“放热”反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因________________________________。
③在一定的温度和压强下,把2体积N2和6体积H2充入一容积可变的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0。反应达到平衡后N2的质量分数为a%,若在相同容器中充入m 摩尔的N2和n 摩尔的H2也能使平衡时N2的质量分数达到a%,则m 和n 的关系用代数式表达应为___________。若在一定温度下的定容密闭容器中发生上述反应,能说明此反应已达化学平衡状态的是________。
2NH3(g) △H<0。反应达到平衡后N2的质量分数为a%,若在相同容器中充入m 摩尔的N2和n 摩尔的H2也能使平衡时N2的质量分数达到a%,则m 和n 的关系用代数式表达应为___________。若在一定温度下的定容密闭容器中发生上述反应,能说明此反应已达化学平衡状态的是________。
A.密度不变 B.混合气体平均相对分子质量不变
C.V正(N2)= 2v逆(NH3) D.N2的体积分数不再改变
(2)体积均为10mL,pH均为2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH 变化如图:则HX 的电离平衡常数_________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数。稀释后,HX溶液中水电离出来的c (H+)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c (H+),理由是_______________________________________。

(3)已知100℃时,水的离子积常数为1×10-12,将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。
-
氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
| | | | | |
(1)①分析数据可知:大气固氮反应属于___________(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是____________(填“A” 或“B”);比较P1、P2的大小关系________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=______________ (计算结果保留2位有效数字)。
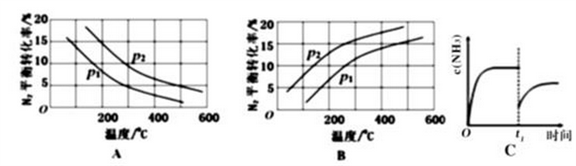
③合成氨反应达到平衡后,t1时刻氨气浓度欲发生图C变化可采取的措施是____________。
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)⇌2NH3(g) △H1=-92.4kJ•mol-1;2H2(g)+O2(g)⇌2H2O(l) △H2=-571.6kJ•mol-1 )
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。


4NH3(g)+3O2(g),则其反应热ΔH=___________________。
2NH3(g) △H=-92.4kJ·mol-1
2H2O(l) △H=-571.6kJ·mol-1 )












