-
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
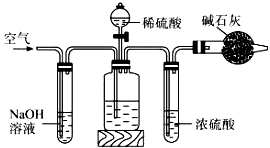
甲 乙 丙 丁
(1)甲装置反应的离子方程式是 。
(2)乙装置反应完成后,再通数分钟空气的作用是 。
(3)若取n g样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为m g,实验结束后称得干燥管丁的总质量为w g,则Na2CO3质量分数的计算式为 。
(4)若去掉丙装置,测得的CO2质量会 (填“偏大” “偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是 。
-
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。
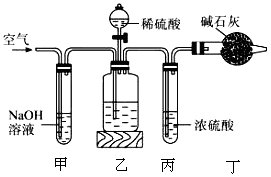
(1)甲装置反应的离子方程式是________________________。
(2)乙装置反应完成后,再通数分钟空气的作用是______________。
(3)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为wg,则Na2CO3质量分数的计算式为______________。
(4)若去掉丙装置,测得的CO2质量会______________(填“偏大”“偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是__________________。
-
某纯碱样品含有少量 杂质,某兴趣小组用如图所示装置测定纯碱样品中
杂质,某兴趣小组用如图所示装置测定纯碱样品中 的质量分数(铁架台、铁夹等均已略去)。
的质量分数(铁架台、铁夹等均已略去)。
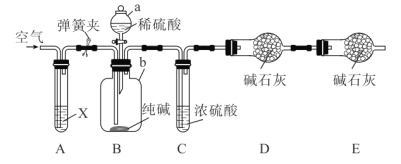
实验步骤如下:
Ⅰ.按图连接装置,并检查气密性;
Ⅱ.准确称量盛有碱石灰的干燥管 的质量为
的质量为 ;
;
Ⅲ.准确称量 纯碱样品放入容器
纯碱样品放入容器 中;
中;
Ⅳ.打开分液漏斗 的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
Ⅴ.打开弹簧夹,往试管 中缓缓鼓入空气数分钟,最后称得干燥管
中缓缓鼓入空气数分钟,最后称得干燥管 的质量为
的质量为 。
。
请回答下列问题:
(1)检查装置 气密性的方法为____________。
气密性的方法为____________。
(2)装置 中试剂
中试剂 应选择_____,目的是________。
应选择_____,目的是________。
(3)装置 的作用是____,步骤
的作用是____,步骤 中“缓缓鼓入空气数分钟”的目的是____________。
中“缓缓鼓入空气数分钟”的目的是____________。
(4)根据实验中测得的有关数据,计算纯碱样品 的质量分数为___(保留三位有效数字),若没有装置
的质量分数为___(保留三位有效数字),若没有装置 ,会导致测量结果____(填“偏大”“偏小”或“无影响”)。
,会导致测量结果____(填“偏大”“偏小”或“无影响”)。
-
某纯碱样品中含有少量NaCl杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去;碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)。
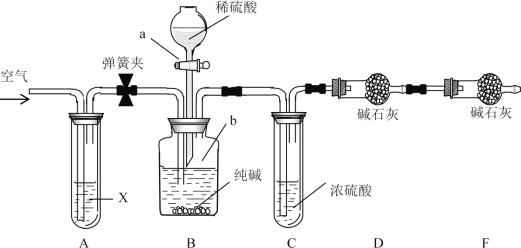
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为80.20g;
③准确称得20.00g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入一定量空气;
⑥然后称得干燥管D的总质量为86.36g ;
⑦重复步骤⑤和⑥的操作,直到干燥管D的质量不变,为86.80 g。
试回答:
(1)装置B中发生反应的离子方程式_________________________________;
(2)装置A中试剂X应选用足量的(______)
A.饱和NaCl溶液 B.浓H2SO4
C.NaHCO3溶液 D.NaOH溶液
(3)①请用文字叙述装置C的作用:__________________________________。
②请用文字叙述装置E的作用:__________________________________。
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,则会导致测定结果_____(填“偏大”、 “偏小”或“不变”,下同);若没有操作⑤⑦,则会导致测定结果__________。
(5)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________。
-
工业纯碱中常含有少量的NaCl杂质,某化学兴趣小组取ag工业纯碱样品与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体。则该样品中纯碱的质量分数是( )
A. ×100% B.
×100% B. ×100%
×100%
C. ×100% D.
×100% D. ×100%
×100%
-
工业纯碱中常含有少量的NaCl杂质,某化学兴趣小组取a g纯碱样品与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该样品中纯碱的质量分数为( )
A. ×100% B.
×100% B. ×100%
×100%
C. ×100% D.
×100% D. ×100%
×100%
-
工业生产的纯碱常含有少量的氯化钠杂质。如图是测定产品中碳酸钠质量分数的实验装置,下列说法不正确的是( )
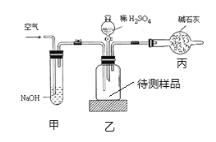
A.装置乙中发生的反应方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
B.装置甲的作用是除去空气中的二氧化碳气体
C.反应结束后再需缓缓鼓入空气数分钟
D.若实验操作无误,该装置测得的碳酸钠的质量分数结果偏小
-
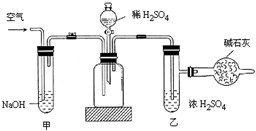
工业生产的纯碱常含有少量的NaCl等杂质.右图是测定产品中Na2CO3质量分数的实验装置.操作步骤有:
A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为Wg
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是(填符号):C→______→E→______→D→______→G→______→F
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是______,装置甲的作用是______,装置乙的作用是______.
(3)计算溶液中Na2CO3的质量分数的计算式是______.
(4)若去掉装置甲,测定结果会______,若去掉装置乙,测定结果会______.(填“偏大”、“偏小”或“无影响”)
-
工业生产的纯碱常含有少量的NaCl等杂质。右图是测定产品中Na2CO3质量分数的实验装置。操作步骤有:

A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为Wg
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是(填符号):
C→______→E→______→D→______→G→______→F
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是_________________,装置甲的作用是____________________,装置乙的作用是______________。
(3)计算溶液中Na2CO3的质量分数的计算式是_____________________。
(4)若去掉装置甲,测定结果会________,若去掉装置乙,测定结果会________。(填“偏大”、“偏小”或“无影响”)
-
某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
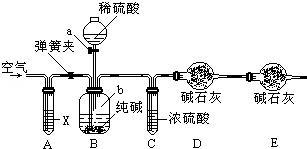
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”);
(2)鼓入空气的目的是 ,装置A中试剂X应选用 ;
(3)若没有C装置,则会导致测定结果 (填“偏大”或“偏小”);
(4)E装置的作用是 ;
(5)装置B中发生反应的离子方程式 ;
(6)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为 (计算结果保留一位小数).







