-
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题。回答下列问题:
(1)Li4SiO4可用于富集CO2,原理是在500℃ ,低浓度CO2与Li4SiO4接触后反应生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生,700℃时反应的化学方程式为________。
(2)CO2加氢合成低碳烯烃的技术在节能减排等方面具有重要意义。以合成C2H4为例,该转化分为两步进行:
第一步:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.3kJ·mol-1
第二步,2COg(g)+4H2(g)=C2H4(g)+ 2H2O(g) △H=-210.5kJ·mol-1
①CO2氢合成乙烯的热化学方程式为_________。
②-定条件下的密闭容器中,总反应达到平衡,要提高CO2的转化率.可以采取的措施是______(填字母)。
A.减小压强 B.增大H2的浓度 C.加入适当催化剂 D.分离出H2O(g)
(3)由CO2和H2合成CH3OH 的反应如下:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H,在10L的恒容密闭容器中投入1molCO2和2.75molH2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
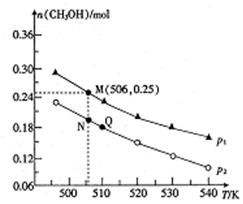
①上述反应的△H______(填“> “或“<”),判断理由是______。
②图中压强p1______(城“>”或“<”)p2。
③经测定知Q点时容器的压强是反应前压强的9/10,若反应从开始到平衡所需的时间为5min,则0~5min内H2的反应速率v(H2)=_____________。
④N点时,该反应的平衡常数K=_______(计算结果保留2位小数)。
-
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题。
Ⅰ.CO2可以与H2反应合成C2H4,该转化分两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.3kJ·mol-1
CO(g)+H2O(g) △H=+41.3kJ·mol-1
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=–210.5kJ·mol-1
C2H4(g)+2H2O(g) △H=–210.5kJ·mol-1
(1)CO2与H2反应反应合成乙烯的热化学方程式为___。
(2)一定条件下的密闭容器中,要提高CO2合成乙烯的转化率,可以采取的措施是____(填标号)。
①减小压强 ②增大H2的浓度 ③加入适当催化剂 ④分离出H2O(g)
(3)己知温度对CO2合成乙烯的平衡转化率及催化剂的催化效率的影响如图所示,下列说法正确的是____(填标号)。
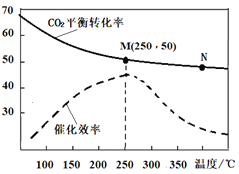
①N点的速率最大
②M点的平衡常数比N点的平衡常数大
③温度低于250℃时,随温度升高乙烯的平衡产率增大
④实际反应尽可能在较低的温度下进行,以提高CO2的转化率
Ⅱ.研究表明CO2和H2在一定条件下可以合成甲醇,反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0mo1CO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0mo1CO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
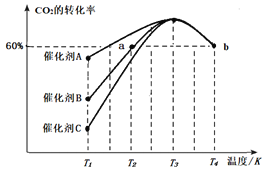
(4)催化效果最佳的是催化剂____(填“A”、“B”或“C”)。
(5)T2温度下,若反应进行10min达到图中a点状态,用CO2的浓度表示的反应速率v(CO2)=____。
(6)图中b点已达平衡状态,则该温度下反应的平衡常数K=____。
(7)在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。表中数据说明,升高温度CO2的实际转化率提高而甲醇的选择性降低,其原因是____。
-
二氧化碳的回收利用是环保和能源领域研究的热点课题。
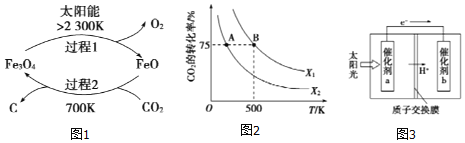
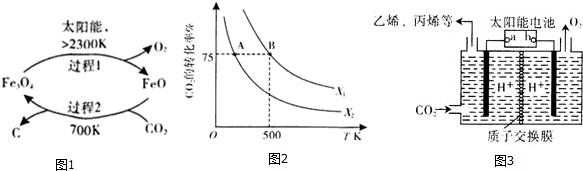
(1)新的研究表明,利用太阳能可以将CO2分解制取炭黑,其原理如右图所示。该过程的能量转化形式为______,在整个过程中,FeO的作用是_________。
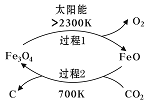
已知:
①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol
②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol 则过程2的热化学方程式为________。
(2)一定温度下,在密闭容器中进行反应CO2(g)+CH4(g) 2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
A.当混合气体的平均相对分子质量不变时,反应达到平衡状态
B.升高温度,加快反应速率,CO2的转化率降低
C.增大CO2的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、H2的体积分数不一定相等
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应CO2(g)+3H2(g) CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比
CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比 的关系如右图所示。
的关系如右图所示。

①若从反应开始到A点需要10s,则V(H2)= _____。
②该反应的平衡常数表达式为______,若X1=3,则B点的K=___________。
③根据图像判断X1 ____X2(填“>”、“<”或“=”,下同),平衡常数KA ___KB。
④若在500K时,按X1投料,在恒压下进行,达到平衡状态,此时CO2的转化率______75%(填“>”、“<”或“=”)
(4)美国伊利诺大学芝加哥分校(UIC)的研究团队设计出一种突破性的新太阳能电池,能把大气中的二氧化碳转换成碳氢化合物(hydrocarbon)燃料,解决了现代社会的两大挑战:“减少大气的碳含量”以及“有效率地制造高密度能源”。右图是通过CO2和H2O作用制备CH3OH的原理示意图。
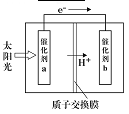
①a电极的名称_________,电极产物___________。
②b电极的电极反应为_________。
-
二氧化碳的回收利用是环保和能源领域研究的热点课题,请根据要求回到下列问题:
(1)研究表明,利用太阳能可以将 分解制收炭黑,其原理如图1所示,制取炭黑的化学反应方程式是______;
分解制收炭黑,其原理如图1所示,制取炭黑的化学反应方程式是______;
已知:①
②
则过程2 的热化学方程式为______。
(2)一定温度下,在密闭容器中进行反应 ,下列说法正确的是______
,下列说法正确的是______ 填字母序号
填字母序号
A.当反应容器中压强不变时,反应达到平衡状态
B.升高温度,加快反应速率, 的转化率增大
的转化率增大
C.增大 的浓度,平衡向正反应方向移动,平衡常数增大
的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、 的体积分数一定相等
的体积分数一定相等
(3)在2L恒容密闭容器中充入 和nmol
和nmol  ,在一定条件下发生反应,
,在一定条件下发生反应, ,
, 的转化率与温度、投料比
的转化率与温度、投料比 的关系如图2所示。
的关系如图2所示。
①该反应的平衡常数表达式为______,若 ,则B点的K______
,则B点的K______ 计算结果精确至
计算结果精确至 ;
;
②若在500K时,按 投料,在恒压下进行,达到平衡状态,此时
投料,在恒压下进行,达到平衡状态,此时 的转化率______
的转化率______ 填“
填“ ”“
”“ ”或“
”或“ ”
” ;
;
(4)某研究团队设计出一种新型太阳能电池,能把大气中的二氧化碳转换成碳氢化合物燃料。如图3是通过
 和
和 作用制备
作用制备 的原理示意图。b电极的电极反应为______。
的原理示意图。b电极的电极反应为______。
-
二氧化碳的回收利用是环保领域研究的热点课题.
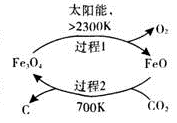
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为 。
(2)CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2= CH2(g) +4H2O(g) △H几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:

则△H=_______________
(3)在2L恒容密闭容器中充入2 moI CO2和nmol H2,在一定条件下发生(2)巾的反应,CO2的转化率与温度、投料比 的关系如右图所示。
的关系如右图所示。
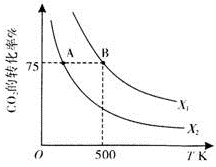
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB。
②若B点的投料比为3,且从反应开始到B点需要10 min,则v(H2)=___________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下。
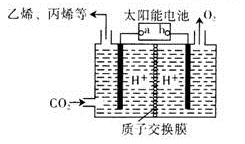
①b电极的名称是 。
②产生丙烯的电极反应式为 。
-
二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。
(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmol H2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X=  ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
-
二氧化碳的回收利用是环保领域研究的热点课题。
(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H
在0.1 MPa时,按n(CO2)︰n(H2)=1︰3投料,如图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
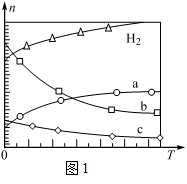
①该反应的△H________0(填“>”、“=”或“<”)。
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 。
(2)向2L恒容密闭容器中充入2 mol CO2(g)和n mol H2(g),在一定条件下发生(1)中反应。CO2的转化率与温度、投料比【X= n(H2)/ n(CO2)】的关系如图2所示:
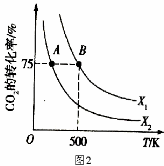
① X1 X2(填“<”、“>”或“=”,下同),平衡常数K(A) K(B)。
② 若B点的投料比为3,则平衡常数K(B)为 (结果保留小数后一位)。若反应从开始到B点需要10 min,则v(H2)= 。
(3)在强酸性的电解质水溶液中,惰性材料做电极,利用太阳能将CO2转化成低碳烯烃,工作原理如图3所示。
① 该工艺中能量转化方式主要有 。
② b为电源的__________(填“正”或“负”)极,电解时,生成丙烯的电极反应式是 。
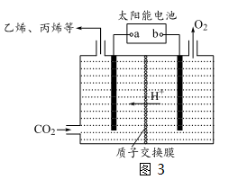
(4)以CO2为原料制取碳(C)的太阳能工艺如图4所示。
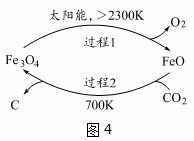
①过程1中发生反应的化学方程式为 。
②过程2中每生成1mol Fe3O4转移电子的物质的量为 。
-
“低碳经济”备受关注,二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g)△H=-41kJ·mol-1
H2(g)+CO2(g)△H=-41kJ·mol-1
②CH4(g) C(s)+2H2(g)△H=+73kJ·mol-1
C(s)+2H2(g)△H=+73kJ·mol-1
③2CO(g) C(s)+CO2(g)△H=-171kJ·mol-1
C(s)+CO2(g)△H=-171kJ·mol-1
写出CO2与H2反应生成CH4和水蒸气的热化学方程式:_________________________。
(2)CO2与H2在催化剂作用下可以合成二甲醚,反应原理如下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z=
CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z= ]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
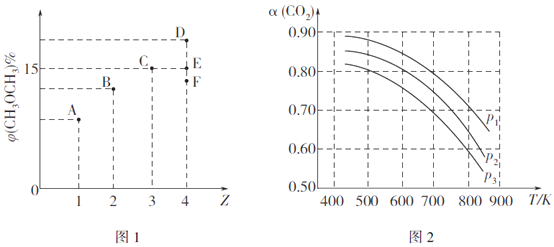
①当Z=3时,CO2的平衡转化率a=__________%。
②当Z=4时,反应达到平衡状态后,CH3OCH3的体积分数可能是图1中的_________点(填"D"、"E"或“F")。
③由图2可知该反应的△H_______0(选填“>”、“<“或“=”,下同),压强p1、p2、p3由大到小的顺序为__________。
④若要进一步提高H2的平衡转化率,除了可以适当改变反应温度和压强外,还可以采取的措施
有________________(任写一种)。
(3)我国科研人员研制出的可充电"Na-CO2"电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
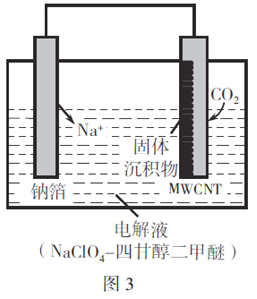
①放电时,正极的电极反应式为____________________。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28g时,转移电子的物质的量为__________。
③可选用高氯酸钠-四甘醇甲醚作电解液的理由是________________________。
-
二氧化碳的回收利用是环保领域研究的热点课题。
(1)以CO2与NH3为原料合成尿素[CO(NH2)2]的技术已十分成熟。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.47 kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+28.49kJ•mol-1
③H2O(g)=H2O(l) △H=-88.0kJ•mol-1
则NH3和CO2合成尿素和气态水的热化学方程式为___。
(2)已知:工业上在120℃条件下利用NH3和CO2合成尿素。在恒温恒容条件下,下列能说明合成尿素反应达平衡的是___
A.NH3和CO2的比例保持不变
B.混合气体的压强不再发生变化
C.2v(NH3)(正)=v(CO2)(逆)
D.混合气体的密度不再改变
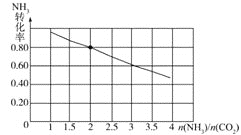
(3)氨碳比[ ]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[
]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[ ]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
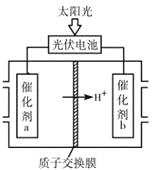
(4)研究人员设计出一种新型太阳能电池,能直接把CO2和H2O转化为CO、H2和O2,原理如图所示,该装置中能量转化方式为___,催化剂b表面的电极反应式为___。
-
CO、CO2是火力发电厂释放出的主要尾气,它们虽会对环境造成负面影响,但也是重要的化工原料,其回收利用是环保领域研究的热点课题。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L 的密闭容器中投入一定量的CO与Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g) COCl2(g) ΔH=a kJ/ mol。
COCl2(g) ΔH=a kJ/ mol。
反应过程中测定的部分数据如下表:
| t/ min | n (CO) /mol | n (Cl2) /mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | | 0.20 |
①反应从开始到2min 末这一段时间内的平均速率v(COCl2)=_____mol/(L·min)。
②在2min~4min 间,v (Cl2) 正______v (Cl2)逆(填“>”、“<”或“=”),该温度下K=_______。
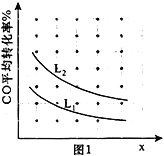
③已知X、L可分别代表温度或压强,图1表示L不同时,CO的转化率随X的变化关系。L代表的物理量是_____________;a_________0(填“>”、“<”或“=”)。
(2)在催化剂作用下NO和CO 可转化为无毒气体:
2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
①已知: N2(g)+O2 (g)=2NO(g) △H1= +180.0kJ/mol
2C(s)+O2 (g)=2CO (g) △H2= -221.0 kJ/mol
2C(s)+2O2 (g)=2CO2 (g) △H3= -787.0 kJ/mol
则ΔH=____________。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验(实验条件已经填在下面的实验设计表中)。实验的设计目的是___________________________。
| 实验编号 | T(℃) | NO初始浓度 (mol • L-1) | CO初始浓度 (mol • L-1) | 催化剂的比表面积(m2 • g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
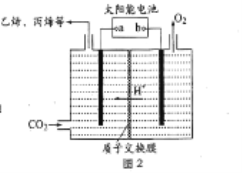
(3)在强酸性的电解质水溶液中,惰性材料作电极,电解CO2可得到多种燃料,其原理如图2 所示。
①b 为电源的_______(填“正”或“负”)极,电解时,生成丙烯的电极反应式是_________。
②侯氏制碱法中可利用CO2、NH3、NaCl等为原料先制得NaHCO3,进而生产出纯碱。已知H2CO3 的Ka1=4.3×10-7 mol•L-1、Ka2=5.6×10-11 mol•L-1,NaHCO3溶液中各离子浓度由大到小的顺序为________。





















