-
有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是_______________。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
高二化学推断题中等难度题查看答案及解析
-
有A、B、C、D、W五种元素.W的原子序数为29,其余的均为短周期主族元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个未成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物.根据以上条件,回答下列问题:
(1)推断元素名称:A______.
(2)C元素的氢化物的空间构型为______,分子中的化学键______(填“有”或“无”)极性,其分子为______分子(填“极性”或“非极性”).
(3)比较A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示),A、B、C三种元素的氢化物的沸点高低______(用化学式表示).
(4)写出D元素原子基态时的电子排布式______,其在元素周期表中的位置______.
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过______键形成的______(填化学式)而显示出的颜色.高二化学解答题中等难度题查看答案及解析
-
有A、B、C、D、W五种元素。W的原子序数为29,其余的均为短周期主族元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个未成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物。根据以上条件,回答下列问题:
(1)推断元素名称:A________。
(2)C元素的氢化物的空间构型为________,分子中的化学键________(填“有”或“无”)极性,其分子为________分子(填“极性”或“非极性”)。
(3)比较A、B、C三种元素的第一电离能由大到小的顺序________(用元素符号表示),A、B、C三种元素的氢化物的沸点高低________(用化学式表示)。
(4)写出D元素原子基态时的电子排布式________,其在元素周期表中的位置________。
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过________键形成的________(填化学式)而显示出的颜色。
高二化学填空题简单题查看答案及解析
-
(9分).有A、B、C、D、E五种短周期元素,其中A、C、B属于同一周期,且原子序数依次增大;A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式为:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号)。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
高二化学填空题简单题查看答案及解析
-
有A、B、C、D、E 五种元素,其中A、B、C 属于同一周期,A 原子最外层p能级的电子数等于次外层的电子数总数;B 原子最外层中有两个不成对的电子;D、E 原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D 与B的质量比为7: 8;E与B的质量比为1: 1。试回答:
(1)写出基态D原子的电子排布式_______________________。
(2)用电子式表示AE2的形成过程_______________,与AE2 互为等电子体的离子是_______。
(3)相同条件下EB2分子和AB2分子两者在水中的溶解度较大的是____(写分子式),理由是
______________________________。
(4)根据VSEPR模型预测C 的氢化物的立体结构为_________,B、C 两元素的气态氢化物的稳定性大小关系为:_____________(填写化学式)。
(5)C的单质中π键的数目为___,晶体D 的晶胞中的所含原子数为____________。
高二化学综合题中等难度题查看答案及解析
-
(13分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。试回答:
(1)写出D原子的电子排布式────────────────
(2)写出AB2的结构式━━━━━━━━━━━━━━━━━━━━
(3)用电子式表示AE2的形成过程━━━━━━━━━━━━━━━━━━━━
(4)B、C两元素的第一电离能大小关系为:───>────(填写元素符号),原因是───────────────────────────────────── 。
(5)根据VSEPR模型预测C的氢化物的立体结构为────────── ,中心原子C的轨道杂化类型为──────── 。
(6)C的单质中π键的数目为────── ,B、D两元素的气态氢化物的稳定性大小关系为:───>────(填写化学式)。
高二化学填空题中等难度题查看答案及解析
-
(10分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D元素与B元素的质量比为7:8;E元素与B元素的质量比为1:1。试回答:
(1)写出D原子的电子排布式____________________。
(2)用电子式表示AE2的形成过程________________________________________。
(3)B、C两元素的第一电离能较大的元素是:________(填写元素符号)。
(4)C的氢化物的VSEPR模型为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为:________>________(填写化学式)。
(6)由元素D组成的单质晶体中,与某个D原子距离最近的D原子有_____个;1molD的氧化物晶体中,含D-O键的数目____________。
高二化学填空题困难题查看答案及解析
-
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8;E与B的质量比为1∶1。试回答:
(1)写出D原子的电子排布式__________。
()用电子式表示AE2的形成过程__________。
(3)B、C两元素的第一电离能大小关系为__________>__________(填元素符号),原因是__________。
高二化学填空题中等难度题查看答案及解析
-
(题文)有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数:;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. B、C两元素的第一电离能大小关系为B>C
B. 用电子式表示AD2的形成过程为
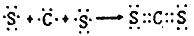
C. 由B60分子形成的晶体与A60相似,分子中总键能: B60>A60
D. D原子的简化电子排布式为[Ar]3s23p4
高二化学单选题中等难度题查看答案及解析
-
有A、B、C、D四种元素,其中A、B、C属于同一周期, A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个未成对的电子; C元素可分别,与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. AD2 的电子式为
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60 >A60
高二化学单选题中等难度题查看答案及解析