-
工业上一般在酸性条件下用N2H4 • H2O(水合肼)、SO2和FeSO4来处理含Cr2O72-废水。回答下列问题:
(1)N2H4 • H2O(水合肼)与Cr2O72-反应时,产物中含有N2和以Cr3+。该反应的离子方程式为___________,反应中水合肼作_____________(填“氧化剂”或“还原剂”)。
(2)SO2处理含Cr2O72-的废水时,先向废水中通入过量SO2,再用NaOH中和废水,使其pH值为8,过滤出Cr(OH)3。
①废水中的Cr2O72-与SO2反应时,氧化剂与还原剂的物质的量之比为____________。
②用碱中和时,pH不宜过大,否则沉淀又逐渐溶解,已知Cr3+与Al3+化学性质相似,写出pH过大时沉淀溶解的离子方程式________________ 。
(3)铁氧体法是用FeSO4作还原剂,在pH≈2时将Cr2O72- 还原为Cr3+,然后调节pH为7.5~8.5,再加热得到铁氧体(组成类似于Fe3O4,部分Fe3+被Cr3+替换)。现有100 L含Cr2O72-浓度为2×10-4 mol·L-1的强酸性废水,向其中加入一定量的FeSO4·7H2O,搅拌,充分反应后再加入NaOH溶液调节pH并加热,使其恰好转化为 [Fe2+Fex3+Cry3+ ]O4。则处理100L该废水时需加入的FeSO4·7H2O的质量为________g。
高三化学简答题困难题查看答案及解析
-
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
高三化学填空题困难题查看答案及解析
-
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:_____。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为_____;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为_____mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。_____________________
高三化学计算题中等难度题查看答案及解析
-
工业上处理含有Cr2O72-的酸性工业废水,通常有两种处理方法。第一种方法是:先加入绿矾(FeSO4·7H2O),把废水中的Cr2O72-还原成Cr3+离子,再加入过量的石灰水,使Cr3+转变为Cr(OH)3沉淀。第二种方法是:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极________,阴极________。
(2)Cr2O72-转变成Cr3+的离子反应方程式:________。
(3)采用第二种方法时,往工业废水里加入适量的NaCl的目的是________。
(4)能否用石墨电极来代替Fe电极?(填“能”或“不能”),简述理由:
________。
高三化学填空题中等难度题查看答案及解析
-
铁氧磁体法处理含Cr2O72-的废水的原理如下:向含Cr2O72-的酸性废水中加入FeSO4·7H2O,将Cr2O72-还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeII [FeIIIx·CrIII2-x]O4 (铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是 ( )
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8 D.x=1.5,a=10
高三化学单选题中等难度题查看答案及解析
-
目前处理酸性Cr2O72-废水多采用铁氧磁体法,该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于:
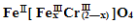
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是( )
A.x =0.5,a =8
B.x =0.5 ,a = 10
C.x = 1.5,a =8 D.x = 1.5 ,a = 10
高三化学选择题困难题查看答案及解析
-
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
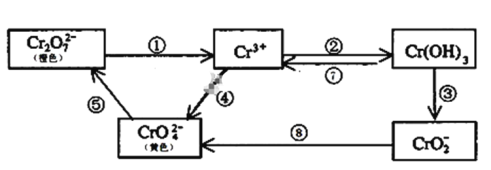
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式: _____Cr2O72-+________________________Fe3O4 +________________________________ H+ →________________________________Cr3+ +________________________________Fe3+ +________________________H2O,_________________
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为____________________;
②滴定时加入的指示剂通常为________________,滴定至终点的现象是________________;
③Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
高三化学综合题中等难度题查看答案及解析
-
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
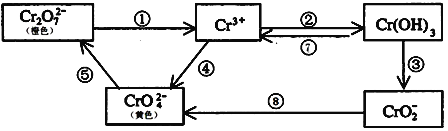
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72- +________________________________________Fe3O4 +________________________________________________________ H+ →________________________________________Cr3+ +________________________________________________Fe3+ +________________________________________________H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
高三化学简答题极难题查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融)
Mg+Cl2↑
B.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+=2Cr3++Fe3++7H2O
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)
CaCO3(s)+Na2SO4(aq)
D.向Ca(ClO)2溶液中通入少量CO2:Ca2++2C1O-+H2O+CO2=2HC1O+CaCO3↓
高三化学选择题中等难度题查看答案及解析
-
下列水处理方法涉及氧化还原反应的是
A. 用明矾处理水中的悬浮物
B. 用Na2S处理水中的Cu2+、Hg2+等重金属离子
C. 用FeSO4处理含Cr2O72-的酸性废水,再调节pH除去Cr3+
D. 用NaOH处理含高浓度NH4+的废水并回收利用氨
高三化学单选题简单题查看答案及解析