-
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题。甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
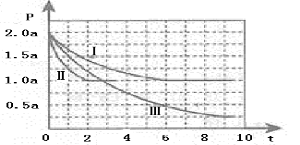
(1)①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在6 min时达到平衡,在此条件下从反应开始到达到平衡时v (CH3OH) = 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后v(正)_______ v (逆)。(填“>”“<”“=”),原因是:_______________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是________________________。
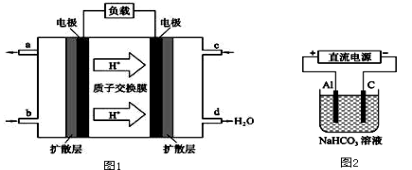
(2)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池负极的电极反应式为: 。
②以此电池作电源进行电解,装置如图2所示。发现溶液逐渐变浑浊并有气泡产生,其原因是 (用相关的离子方程式表示)。
-
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题。甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
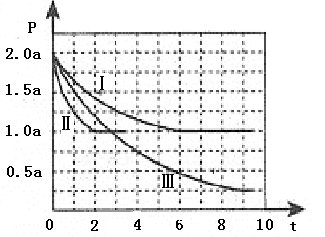
(1)①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在6 min时达到平衡,在此条件下从反应开始到达到平衡时v (CH3OH) = 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后v(正)_______ v (逆)。(填“>”“<”“=”),原因是________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是_____________________________。
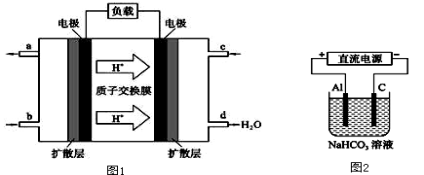
(2)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池负极的电极反应式为: 。
②以此电池作电源进行电解,装置如图2所示。发现溶液逐渐变浑浊并有气泡产生,其原因是
(用相关的离子方程式表示)。
-
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)Ⅱ和Ⅰ相比,改变的反应条件是 .
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= .
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)= .
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是 .
-
(15分)清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
Ⅰ、一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)Ⅱ和Ⅰ相比,改变的反应条件是 .
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= .
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)= .
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是 .
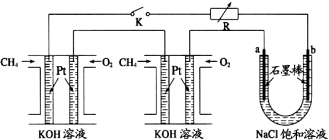
Ⅱ、甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题:
(5)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:

通入a气体的电极是原电池的 极(填 “正”或“负”),其电极反应式为 。
(6)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。
-
应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源.甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景.回答下列问题:
(1) 与
与 合成甲醇:
合成甲醇: 但是找到合适的催化剂是制约该方法的瓶颈.目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险.最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现
但是找到合适的催化剂是制约该方法的瓶颈.目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险.最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示.
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示.
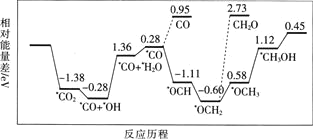
容易得到的副产物有CO和 ,其中相对较多的副产物为________________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中________
,其中相对较多的副产物为________________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中________ 填字母
填字母 的能量变化.
的能量变化.
A. B.
B.
C. D.
D.
(2)恒压 容器的容积可变
容器的容积可变 下,
下, 与
与 在催化剂作用下发生反应
在催化剂作用下发生反应
 ,
, 的平衡转化率与温度、压强的关系如图所示.
的平衡转化率与温度、压强的关系如图所示.
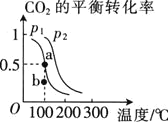
①压强 ________
________ 填“
填“ ”或“
”或“ ”
” .
.
②在 、
、 条件下,b点时
条件下,b点时 ________
________ 填“
填“ ”或“
”或“ ”
” .
.
③已知:反应速率 ,
, 、
、 分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为
分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为 ,计算b处的
,计算b处的 ________
________ 保留3位有效数字
保留3位有效数字 .
.
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应 Ⅰ
Ⅰ 、
、 Ⅱ
Ⅱ 的
的 为以分压表示的平衡常数
为以分压表示的平衡常数 与T的关系如下图所示.
与T的关系如下图所示.
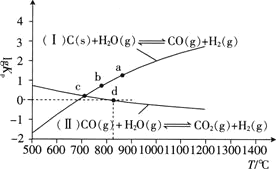
①反应 Ⅱ
Ⅱ 的
的 ________
________ 填“大于”“等于”或“小于”
填“大于”“等于”或“小于” .
.
② 点时,反应
点时,反应 的
的 ________
________ 填数值
填数值 .
.
③在恒容密闭容器中充入 、
、 只发生反应
只发生反应 Ⅱ
Ⅱ ,图中d点处达到平衡时,CO的转化率为________;达到平衡时,向容器中再充入
,图中d点处达到平衡时,CO的转化率为________;达到平衡时,向容器中再充入 、
、 ,重新达到平衡时,CO的平衡转化率________
,重新达到平衡时,CO的平衡转化率________ 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” .
.
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
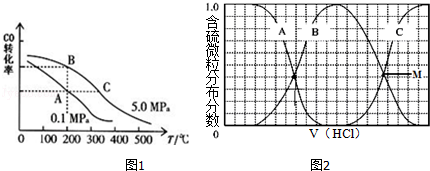
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO (g) + 2H2 (g) ═ CH3OH (g).下列情形不能说明该反应已达到平衡状态的是 (填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体的平均摩尔质量不再变化
C.生成CH3OH的速率与消耗CO的速率相等
D.容器的总压强不再发生变化
(2)CO的平衡转化率(α)与温度、压强的关系如图1所示,B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”),你判断的理由是 ,要在提高CO平衡转化率的同时加快反应速率,可采取的措施是 (任写一条).
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS﹣、S2﹣的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图2所示(忽略滴加过程H2S气体的逸出).试分析:
①B曲线代表 的分布分数变化;滴加过程中,溶液中一定成立:c(Na+)= .(用溶液中的相关微粒浓度表示)
②若M点溶液pH约为7,则H2S第一步的电离平衡常数Ka= .
-
(16分)甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)K(C)(填“>”、“=”或“<”).
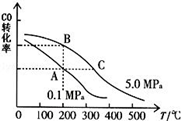
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字).
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序_______ _____
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为__________ .
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
-
(2015秋•山西校级月考)甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
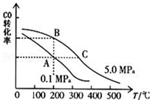
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如右图所示.B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”)
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
-
(13分)甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如下图所示。
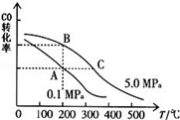
B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”).
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小顺序__ _____
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
①下列情形能说明该反应已达到平衡状态的是___________(填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。B、C两点的平衡常数K(C)____K(B)(填“>”、“=”或“<”)
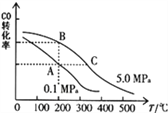
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=______,此温度下的平衡常数K=______(保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V______20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序_____________
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的正极反应式为__________。
CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:















