-
合成氨的反应为N2+3H2 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
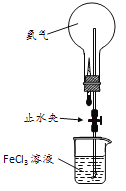
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。
(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。
-
合成氨的反应为N2+3H2 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。

(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。
-
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
A.v(NH3)=0.2 mol/(L·s) B.v(N2)=1.0 mol/(L·min)
C.v(H2)=1.67 mol/(L·min) D.v(H2)=0.3 mol/(L·min)
-
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。

①在1L容器中发生反应,前20min内,v(NH3)=________,放出的热量为________;
②25min时采取的措施是________;
③时段III条件下,反应的平衡常数表达式为(用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
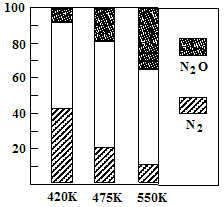
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是________,导致这种规律的原因是(任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是________,导致这种规律的原因是(任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为________。
-
(1)N2(g)+3H2(g)  2NH3(g) ΔH=-94.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图所示。
2NH3(g) ΔH=-94.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图所示。
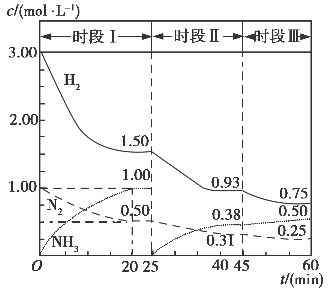
①在1 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②25 min时采取的措施是_______________________;
③时段Ⅲ条件下反应的平衡常数表达式为________(用具体数据表示)。
(2)电厂烟气脱离氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO (g)
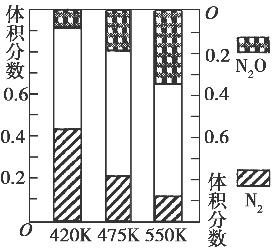
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO (g)  5N2O(g)+3H2O(g) ΔH>0。测得平衡混合气中N2和N2O含量与温度的关系如图。在400~600 K时,平衡混合气中N2含量随温度的变化规律是________,导致这种变化规律的原因是________(任答合理的一条原因)。
5N2O(g)+3H2O(g) ΔH>0。测得平衡混合气中N2和N2O含量与温度的关系如图。在400~600 K时,平衡混合气中N2含量随温度的变化规律是________,导致这种变化规律的原因是________(任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为4NH3+3O2=2N2+6H2O,则负极电极反应式为________。
-
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
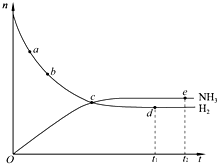
A.点c处正反应速率和逆反应速率相等
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
-
设C+CO2 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2 2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
-
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2→2NH3,氨气的浓度随时间变化如图1所示.

(1)反应到5min时,氢气反应速率______.
(2)在10min时采取的措施是______,A的平衡常数为______,点A的平衡常数K______(填“<”、“>”或“=”)B点的平衡常数.
(3)若合成塔内生成17g氨气放出45.5kJ热量,在图2坐标上画出该合成氨反应过程中能量随时间的变化示意图.
(4)-50°C时,液氨存在如下电离:2NH3⇌NH4++NH-2,k=2×10-2,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH4Cl固体,K______2×10-12(填“<”、“>”或“=”)
-
下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
A.N2、H2、NH3的百分含量相等
B.单位时间,消耗a mol N2的同时消耗3mol H2
C.单位时间,消耗a molN2的同时生成3a mol H2
D.反应若在定容的密器中进行,温度一定时,压强不随时间改变
-
在一定条件下,反应N2+3H2 2NH3在10 L恒容密闭容器中进行,测得2 min内N2的物质的量由20 mol减少到8 mol,则2 min内N2的化学反应速率为
2NH3在10 L恒容密闭容器中进行,测得2 min内N2的物质的量由20 mol减少到8 mol,则2 min内N2的化学反应速率为
A. 1.2 mol/(L·min) B. 1.0 mol/(L·min)
C. 0.6 mol/(L·min) D. 0.4 mol/(L·min)
2NH3+Q。下表是某次反应时NH3的浓度变化:







