-
氮和碳一样也存在一系列氢化物,如NH3、N2H4、N3H5、N4H6等。
请回答下列问题
(1)上述氮的系列氢化物的通式为______________;N3H5的电子式为_____________________。
(2)已知:①4NH3(g)+5O2(g)==4NO(g)+6H2O(g) △H1= a kJ·mol-1 K1
②4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H2= b kJ·mol-1 K2
写出N2 与O2反应生成1mol NO气体的热化学方程式:________________________________;该反应式的平衡常数表达式K=__________________(用含有K1、K2的代数式表示)。
(3)已知NH3·H2O为一元弱碱,N2H4·H2O 为二元弱碱,N2H4·H2O在水溶液中的一级电离方程式为N2H4·H2O+H2O N2H5·H2O++ OH-,则可溶性盐盐酸肼(N2H6Cl2)
N2H5·H2O++ OH-,则可溶性盐盐酸肼(N2H6Cl2)
第一步水解的离子方程式为_________________________________________________;溶液中离子浓度由大到小的顺序为________________________________________________。
(4)如图所示,隔板I固定不动,活塞II可自由移动,M、N 两个容器中均发生反应:N2(g)+ 3H2(g)  2NH3(g)。向M、N 中均通入lmol N2 和2.3 mol H2。初始时M、N 容积相同,并保持温度不变,则达到平衡时H2 的转化率aM(H2)_____aN(H2)(填“>”“=”“或”)。达到平衡时测得容器N 的容积为2.0 L,其中含有0.2 mol NH3,则此条件下该反应的平衡常数K=______________。
2NH3(g)。向M、N 中均通入lmol N2 和2.3 mol H2。初始时M、N 容积相同,并保持温度不变,则达到平衡时H2 的转化率aM(H2)_____aN(H2)(填“>”“=”“或”)。达到平衡时测得容器N 的容积为2.0 L,其中含有0.2 mol NH3,则此条件下该反应的平衡常数K=______________。

-
氮元素也与碳元素一样存在一系列氢化物,如NH3、N2H4、N3H5、N4H6等。请回答下列有关问题:
(1)上述氮的系列氢化物的通式为____________。
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,查阅文献资料,化学键键能如下表:
| 化学键 | H-H | N=N | N-H |
| E/kJ·mol-1 | 436 | 946 | 391 |
①氨分解反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
 N2(g)+
N2(g)+  H2(g)
H2(g) NH3(g)的活化能Ea2=___________。
NH3(g)的活化能Ea2=___________。
②氨气完全燃烧生成氮气和气态水的热化学方程式为__________________________。
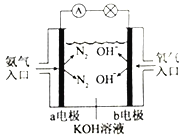
③如右图是氨气燃料电池示意图。a电极的电极反应式为________________。
(3)已知NH3·H2O为一元弱碱。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为:N2H4·H2O+H2O N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
(4)通过计算判定(NH4)2SO3溶液的酸碱性(写出计算过程)________________________。(已知:氨水Kb=1.8×10-5;H2SO3 Ka1=1.3×10-2 Ka2=6.3×10-8)。
-
氮和碳一样也存在一系列氢化物如NH3、N2H4、N3H5、N4H6等。
(1)N3H5的电子式为_______。
(2)已知4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=a kJ/mol K1①;
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol K2②;
写出N2与O2反应生成1 mol NO气体的热化学方式程式为________________________;
(3)已知NH3·H2O为一元弱碱,N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O+H2O N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
(4)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)

①向M、N中,各通入2 mol N2和6 mol H2。初始M、N容积相同,并保持温度不变。则到达平衡时H2的转化率α(H2)为M________N(填“>”“=”“<”)。
②若在某条件下,反应N2(g)+3H2(g) 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
-
(8分)
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
-
(本题共12分)
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ∙mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 =-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________。
Ⅱ、一定质量的液态化合物 在标准状况下的一定质量的
在标准状况下的一定质量的 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为:  ===
=== 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56  则:
则:
(1)反应前 的体积是________。 (2)化合物
的体积是________。 (2)化合物 的摩尔质量是________。
的摩尔质量是________。
(3)若 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和________ (写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和________ (写元素符号)。
-
(12分)Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数为__________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) === XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。
-
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
(1)氮元素原子的L层电子数为______;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:
①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ∙mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式______;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为______.
Ⅱ、一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)═XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g•L-1,则:
(1)反应前O2的体积是______.
(2)化合物XY2的摩尔质量是______.
(3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为______和______ (写元素符号).
-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________;
(3)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2H4 (1)△H1=-195kJ•mol-1
②N2O4(1)+O2(g)=N2(g)+2H2O△H2=-534.2kJ•mol-1写出肼和N2O4反应的热化学方程式________;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反为________.
-
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为______;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ•mol-1
写出肼和N2O4反应的热化学方程式____________;
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________。
N2H5·H2O++ OH-,则可溶性盐盐酸肼(N2H6Cl2)
2NH3(g)。向M、N 中均通入lmol N2 和2.3 mol H2。初始时M、N 容积相同,并保持温度不变,则达到平衡时H2 的转化率aM(H2)_____aN(H2)(填“>”“=”“或”)。达到平衡时测得容器N 的容积为2.0 L,其中含有0.2 mol NH3,则此条件下该反应的平衡常数K=______________。
