-
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
(二)某科研单位利用原电池原理,用SO2和O2制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
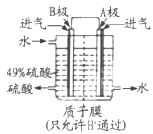
(3)B电极的电极反应式为______;溶液中H+的移动方向由______极到______极;电池总反应式为______。
(三)利用烧渣制绿矾的过程如下
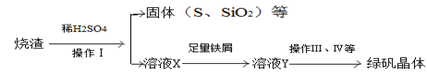
测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL。溶液。
b.量取25 ml。待测液于锥形瓶中。
c.用硫酸酸化的0. 01 mol/LKMnO4 溶液滴定至终点,消耗KMnO4溶液体积40 mL。根据上述步骤同答下列问题。
(4)滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。

(5)用硫酸酸化的KMnO4滴定终点的标志是
(6)计算上述产品中的FeSO4.7H2O质量分数为______。
-
(15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:________.
②该反应达到平衡状态的标志是________.
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
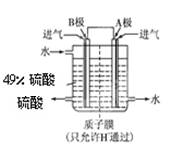
①B电极的电极反应式为________;
②溶液中H+的移动方向由________极到________极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
________Fe2++________ + ________ ________——________Fe3++________Mn2++________ ________
+ ________ ________——________Fe3++________Mn2++________ ________
②用硫酸酸化的KMnO4滴定终点的标志是________.
③计算上述产品中FeSO4·7H2O的质量分数为 .
-
化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如 下:

(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。
(4)在实验室里,完成过程④中的____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有___________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是____________________________________________________。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
-
(17分)绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
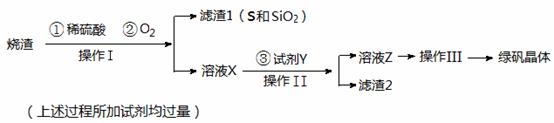
试回答:
(1)操作I为 (填写操作名称)。
(2)操作III的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(3)试剂Y(一种单质)与溶液X反应的离子方程式为 。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)

③滴定时发生反应的离子方程为:
④若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为
-
(14分)绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:

试回答:
(1)操作Ⅰ为________(填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为________ 。
(3)操作Ⅲ的顺序依次为:________、冷却结晶、过滤 、 ________、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是________(夹持部分略去)(填字母序号)

③滴定时发生反应的离子方程式为: ________ 。
④判断此滴定实验达到终点的方法是________;若在滴终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为
-
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:

试回答:
(1)操作I为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 。
(3)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。

-
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
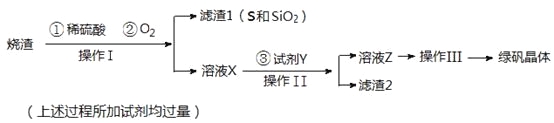 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。
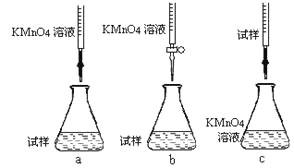
③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
-
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。

③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
-
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
 试回答:
试回答:
(1)操作Ⅰ为________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为________ 。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是。
(4)操作Ⅲ的顺序依次为:________、冷却结晶、过滤 、 ________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需________ 。
②该同学设计的下列滴定方式,最合理的是________(夹持部分略去)(填字母序号)。
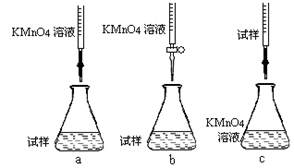
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________。
-
(13分)氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
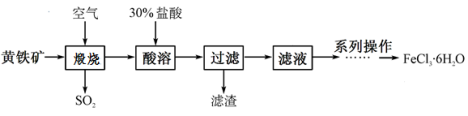
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
2SO3,在一密闭容器中一定时间内达到平衡。










 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
 试回答:
试回答:
