-
实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 产率 65%
1 : 10 97%
(在120 ℃下测定)

已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | ~117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | ~76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机制
用乙醇羟基氧示踪

用醋酸羟基氧示踪



含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机制 。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
为了使正反应有利,通常采用的手段是:
①使原料之一过量。谁过量 ?
无水乙醇3600元/吨,冰醋酸2900元/吨。每摩乙醇 元,每摩冰醋酸 元。
②不断移走产物[例如除水,乙酸乙酯、乙醇、水可形成三元恒沸物(沸点:70.2 ℃),乙酸不能形成三元恒沸物]。综上所述选择 过量。
(3)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
用饱和CaCl2溶液直接洗涤起什么作用: 。
-
某研究性小组探究乙酸乙酯的反应机理,实验如下:

CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | 76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪

用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
-
乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
| 物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
| 熔点/ ℃ | 16.6 | -89.5 | -73.5 |
| 沸点/ ℃ | 117.9 | 117 | 126.0 |
| 密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
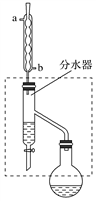
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。
-
乙酸正丁酯是无色透明有果香气味的液体。实验室制备乙酸正丁酯的反应方程式如下:CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
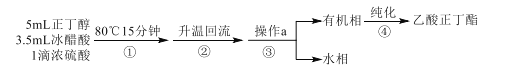

已知:乙酸正丁酯、正丁醇和水组成的三元共沸物的沸点为90.7℃。
反应装置如图所示。在烧瓶中加入反应物和沸石,分水器中加入一定体积水,80℃反应15分钟,然后提高温度使反应处于回流状态,分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。
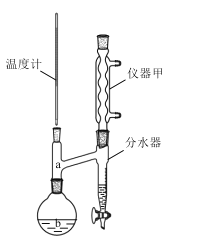
回答下列问题:
(1)仪器甲的名称是___。步骤①在80℃反应时温度计水银球置于___(填“a”或“b”)处。
(2)使用分水器能提高酯的产率,原因是___(用平衡移动原理解释)。
(3)步骤②观察到___(填标号)现象时,酯化反应已基本完成。
A.当分水器中出现分层 B.分水器中有液体回流至烧瓶
C.分水器水层高度不再变化 D.仪器甲有液体滴落
(4)若反应前分水器中加水不足,会导致___,使产率偏低。
(5)步骤③操作a的名称是___。
(6)步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,分出的产物加入少量无水MgSO4固体,蒸馏,得到乙酸正丁酯4.64g。加入10%Na2CO3溶液的目的是除去___。乙酸正丁酯的产率为___%。
-
乙酸乙酯是常见酯类化合物,其实验室制备提纯过程如下:
制备反应:CH3COOH+CH3CH2OH  CH3COOC2H5+H20
CH3COOC2H5+H20
实验步骤:
①按照下图制备装置组装一起
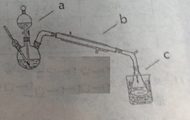
②在三颈瓶中加入4mL乙醇,慢慢振荡加入5mL浓硫酸。仪器a内装预先混合均匀的10mL乙醇和8mL乙酸
③先从a中放出3mL混合液,于石棉网上加热110-120℃.有馏分分出时,打开a活塞,控制流速(每分钟30滴)。至滴加完毕无馏分时停止加热。
④摇动盛粗产品的锥形瓶,向其中加入饱和碳酸钠溶液至有机相呈中性。
⑤将液体转入分液漏斗中,摇振后静置,弃水相。有机相依次用饱和食盐水洗涤后和饱和氯化钙溶液洗涤,每次均弃水相。
⑥有机相转入干燥的锥形瓶,加无水硫酸镁干燥。
试回答:
1、仪器a、b的名称分别为______ 、______。
2、实验步骤②加入过量的乙醇的目的是________。还需要加入______。
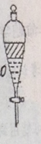
3、实验步骤5中摇荡静置后如图所示,请写出弃水相的操作________。
4、试写出实验过程中发生的副反应的方程式:乙醇被浓硫酸脱水碳化同时放出SO2:________。
5、步骤③中滴加速度过快会使乙酸乙酯的产率降低,造成产率降低的原因可能是:
① ________
②________
-
(13分)乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物。实验室用正丁醇和乙酸制备,反应原理如下:
CH3COOH+CH3CH2CH2CH2OH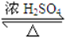 CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
某兴趣小组拟用如图装置制备少量乙酸正丁酯:
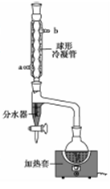
步骤1:加料。向干燥的100ml圆底烧瓶中加入37ml正丁醇、22ml冰醋酸及10滴浓硫酸(试剂加入顺序未确定),摇匀后,加入几粒沸石。然后安装分水器(先在分水器上端小心加水至分水器支管口处,然后再放出1~2ml的水)及回流冷凝管。
步骤2:加热回流。通过活塞控制分水器中水层液面的高度。反应完毕,停止加热。
步骤3:冷却(不可以拆卸回流冷凝管)。冷却至室温后,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中。
步骤4:依次用10ml水,10ml 10%碳酸钠溶液洗至中性(pH=7),再水洗一次,向洗涤后的有机相中加入适量的无水硫酸镁固体。放置一段时间后过滤、蒸馏、收集124~126℃馏分,得产品)
步骤5:用一干燥的小烧杯称产品,重量为29.0g。
相关物质的性质如下表:
| 物质名称 | 沸点/℃ | 熔点/℃ | 密度/g·cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
根据题意完成下列填空:
(1)加料时,三种试剂的加入顺序为 。
(2)该实验中,冷凝水从 (填“a”或“b”)口通入,使用分水器的目的是 。
(3)步骤2中判断反应结束的现象是 。
(4)步骤3中从分液漏斗中得到酯的操作 ,用10% Na2CO3溶液洗涤有机相,是为了除去有机相中的 (填结构简式)。
(5)步骤4中加入无水硫酸镁固体的作用是 。
(6)实验中正丁醇的转化率为 。
-
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应:
 +
+

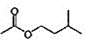 +H2O
+H2O
装置示意图为:
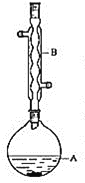
有关数据如下:
| 相对分子质量 | 密度/(g∙cm-3) | 沸点/℃ | 水中溶解性 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入 异戊醇
异戊醇 、数滴浓硫酸和
、数滴浓硫酸和 片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水
片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去 固体,进行蒸馏纯化,收集
固体,进行蒸馏纯化,收集 馏分,得乙酸异戊脂
馏分,得乙酸异戊脂
回答下列问题:
(1)仪器B的名称是_________
(2)在洗涤操作中,第一次水洗的主要目的是_____。第二次水洗的主要目的是_____
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)_______
a、直接将乙酸异戊脂从分液漏斗的上口倒出
b、直接将乙酸异戊从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊脂从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酚从上口倒出
(4)本实验中加入过量乙酸的目的是_____________
(5)实验中加入少量无水 的目的是____________
的目的是____________
(6)在蒸馏操作中,仪器选择及安装都正确的是_________ 填标号
填标号 。
。
a.  b.
b.  c.
c.  d.
d. 
(7)本实验的产率是________ 填标号
填标号
 .
. .
.
(8)在进行蒸馏操作时:若从 便开始收集馏分,会使实验的产率偏_________
便开始收集馏分,会使实验的产率偏_________ 填“高”或“低”
填“高”或“低” ,其原因是___________
,其原因是___________
-
关于反应CH3COOH(l) + C2H5OH(l)  CH3COOC2H5(l) + H2O(l) ΔH=-2.7kJ·mol-1,下列说法正确的是
CH3COOC2H5(l) + H2O(l) ΔH=-2.7kJ·mol-1,下列说法正确的是
A.由于水为液态,移走生成的水平衡不会移动。
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
-
(8分)实验室用乙酸和正丁醇制备乙酸正丁酯的原理如下:
CH3COOH+CH3CH2CH2CH2OH  CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
有关物质的物理性质如下表,请回答有关问题。
| 化合物 | 密度/g·cm-3 | 沸点/℃ | 溶解度/g |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及冷凝回流管,加热冷凝回流反应。
(1)沸石的作用
________________________________________________________________________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是
__________________ ____________;
________________________________________________________________________。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤。正确的操作步骤是________(填字母)。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
-
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 |
| C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是____________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
CH3COOC2H5 + H2O












 CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
 +H2O
+H2O
 b.
b.  c.
c.  d.
d. 