-
(14)铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
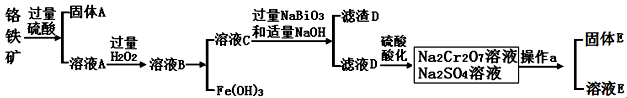
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
②常温下,Ksp[Cr(OH)3]=6.3×10-31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,不选用盐酸的原因是 。
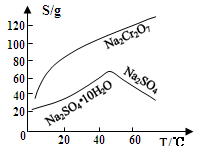
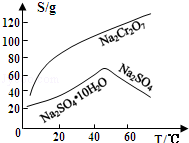
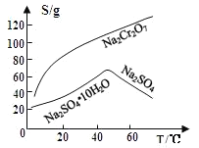
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全 ;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
-
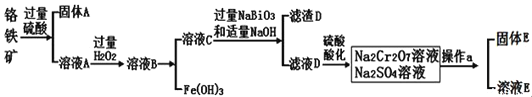
铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下:
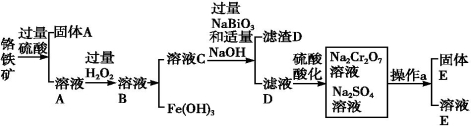
已知:①Na2Cr2O7是一种强氧化剂
②常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42—
⑴工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式: ;
⑵酸化滤液D时,不选用盐酸的原因是 ;
⑶固体E的主要成分是Na2SO4,根据下图分析操作a为 ;

⑷已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72—,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole—,则加入Na2S2O3溶液时发生反应的离子方程式为 ;
⑸根据有关国家标准,含CrO42—的废水要经化学处理,使其浓度降至5.0×10—7mol·L—1以下才能排放。用以下方法处理废水:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10—10],再加入可溶性硫酸盐处理多余的Ba2+。则加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol·L—1,废水处理后方能达到国家排放标准。
-
铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态.工业上以铬铁矿(主要成分为FeO•Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7•2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
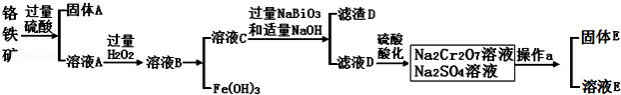
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42﹣
②常温下,Ksp[Cr(OH)3]=6.3×10﹣31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式 .
(2)酸化滤液D时,不选用盐酸的原因是 .
(3)固体E的主要成分是Na2SO4,根据如图分析操作a为 、 .
(4)已知含+6价铬的污水会污染环境.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72﹣,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全 ;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole﹣,则加入Na2S2O3溶液时发生反应的离子方程式为 .
-
铬是一种银白色金属,化学性质稳定,在化合物中常见 、
、 和
和 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿 主要成分为
主要成分为 ,含有
,含有 、
、 等杂质
等杂质 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠 已知
已知  是一种强氧化剂
是一种强氧化剂 ,其主要工艺流程如下:
,其主要工艺流程如下:


查阅资料得知:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为
回答下列问题:
 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
 固体E的主要成分是
固体E的主要成分是 ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
 已知含
已知含 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的 。
。

 的化学性质与
的化学性质与  相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________ 用离子方程式表示
用离子方程式表示 ;
;
 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中 溶液最佳的是___________
溶液最佳的是___________ 填选项序号
填选项序号 ;
;
A  溶液
溶液  浓
浓
 酸性
酸性 溶液
溶液  溶液
溶液
 上述流程中,每消耗
上述流程中,每消耗 转移
转移 ,则加入
,则加入 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
 某厂废水中含
某厂废水中含 的
的 ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料  的化合价为
的化合价为 ,Fe的化合价依次为
,Fe的化合价依次为 、
、 。欲使1L该废水中的
。欲使1L该废水中的  完全转化为
完全转化为 。理论上需要加入________
。理论上需要加入________ 。
。
 已知
已知 摩尔质量为
摩尔质量为
-
铬是一种银白色金属,化学性质稳定,在化合物中常见 、
、 和
和 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿 主要成分为
主要成分为 ,含有
,含有 、
、 等杂质
等杂质 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠 已知
已知  是一种强氧化剂
是一种强氧化剂 ,其主要工艺流程如下:
,其主要工艺流程如下:
查阅资料得知:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为
回答下列问题:
 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
 固体E的主要成分是
固体E的主要成分是 ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
 已知含
已知含 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的 。
。

 的化学性质与
的化学性质与  相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________ 用离子方程式表示
用离子方程式表示 ;
;
 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中 溶液最佳的是___________
溶液最佳的是___________ 填选项序号
填选项序号 ;
;
A  溶液
溶液  浓
浓
 酸性
酸性 溶液
溶液  溶液
溶液
 上述流程中,每消耗
上述流程中,每消耗 转移
转移 ,则加入
,则加入 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
 某厂废水中含
某厂废水中含 的
的 ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料  的化合价为
的化合价为 ,Fe的化合价依次为
,Fe的化合价依次为 、
、 。欲使1L该废水中的
。欲使1L该废水中的  完全转化为
完全转化为 。理论上需要加入________
。理论上需要加入________ 。
。
 已知
已知 摩尔质量为
摩尔质量为
-
重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工业流程如图所示:
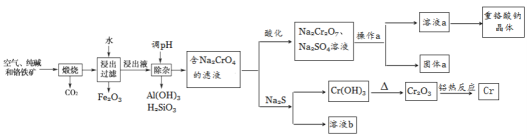
已知部分物质的溶解度曲线如图1所示。
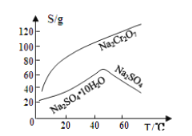
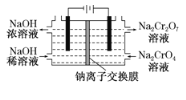
图1 图2
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为______________________________。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_________(填化学式)。
(3)调节溶液的pH所选的试剂为__________________(填名称)。
(4)操作a的实验步骤为 _________________________。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式__________________________________。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式:___________________________________。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为____________。
(7)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________mol·L-1 ,废水处理后方能达到国家排放标准。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O。

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:______________、________________。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,写出该反应的化学方程式: 。
简述检验溶液中是否存在Fe3 +的方法是: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(5)铬(Cr)与铝的性质相似,试写出Cr(OH)3 溶于NaOH 溶液所发生反应的离子反应方程式: 。
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
高温
①4(FeO·Cr2O3)+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是 ( )
A.反应①和②均为氧化还原反应
B.Na2CrO4中Cr元素的化合价为+7
C.反应①的氧化剂是02.还原剂是FeO·Cr2O3
D.反应②中生成1mol的Na2Cr2O7时共转移7mol电子
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4→Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D.反应(1)中每生成1molNa2CrO4时电子转移3mol
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2  8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4  Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D.反应(1)中每生成1molNa2CrO4时电子转移3mol


















