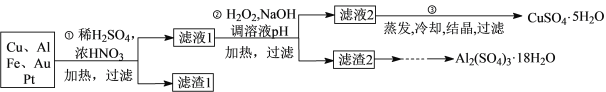-
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4•5H2O):
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(1)滤渣Ⅰ的主要成份是(写化学式)______。
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ= 2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O = 2Iˉ+S4O
= 2Iˉ+S4O
求样品中胆矾晶体的质量分数(写出计算过程)。
-
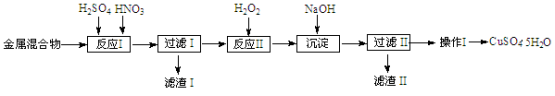
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70% Cu、25% Al、4% Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Fe与过量的浓 HNO3 反应的离子方程式为_________,得到滤渣 1 的主要成分为__________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为Fe3+,用H2O2 做氧化剂的优点是______。
(3)滤渣 2 的主要成分是 Al(OH)3 和 Fe(OH)3,在生产中利用何种化学原理分离两种沉淀,写出反应的离子方程式_______。
(4)第③步蒸发所需玻璃仪器为________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70% Cu、25% Al、4% Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Fe与过量的浓 HNO3 反应的离子方程式为_________,得到滤渣 1 的主要成分为__________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为Fe3+,用H2O2 做氧化剂的优点是______。
(3)滤渣 2 的主要成分是 Al(OH)3 和 Fe(OH)3,在生产中利用何种化学原理分离两种沉淀,写出反应的离子方程式_______。
(4)第③步蒸发所需玻璃仪器为________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________,得到滤渣 1的主要成分为_______________。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________。
(4)第③步蒸发所需玻璃仪器为__________________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
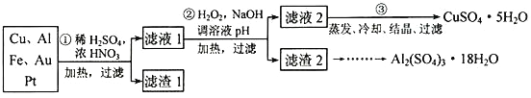
请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________,得到滤渣 1的主要成分为_______________。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________。
(4)第③步蒸发所需玻璃仪器为__________________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe 及少量Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
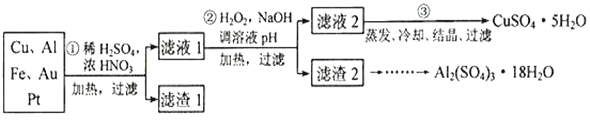
请回答下列向题:
(1)第①步Cu与酸反应的离子方程式___________________,得到滤渣1的主要成分为_________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的Fe2+离子氧化为Fe3+,写出该反应的离子方程式_______________________________,用H2O2做氧化的优点是__________________。
(3)滤渣2的主要成分中Al(OH)3和Fe(OH)3在生产中如何分离两种沉淀,写出反应的离子方程式:_____________________________________________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
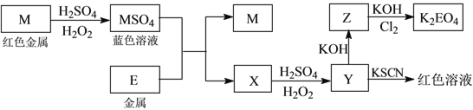
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:_______________________________。
(2)检验X中阳离子的方法和现象是__________________________________________________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________________________、____________________________________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 __________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
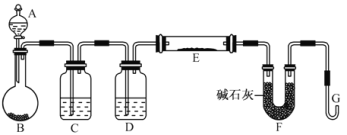
①仪器B中应装入___________,装置D的作用_________________________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
___________________________在这两步之间还应进行的操作是_________________________;
-
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
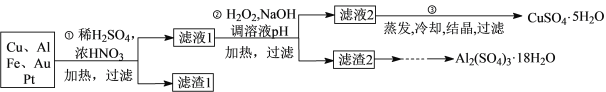
回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
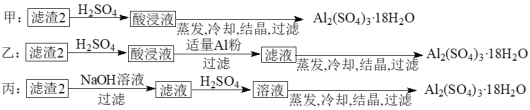
上述三种方案中,______方案不可行 。
-
某学生探究小组将一批废弃的电子线路板简单处理后,得到含71%Cu、20%Al、5%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
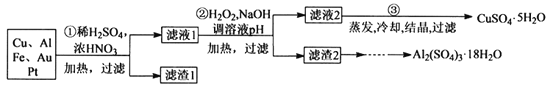
已知:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
回答下列问题:
(1)滤渣1的主要成分为___。
(2)第②步加入H2O2目的是将Fe2+氧化成Fe3+,其离子方程式为___;使用H2O2作为氧化剂的优点是___。
(3)用第③步所得CuSO4·5H2O晶体加热制备无水CuSO4的瓷质主要仪器___。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:

上述三种方案中,可行方案是___,其中不可行方案的原因是___。
-
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
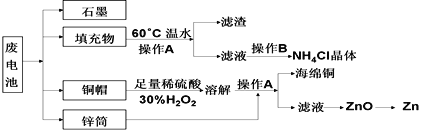
(1)石墨中化学键类型为______________,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________。
(5)操作A的名称为______________。
(6)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)

= 2Iˉ+S4O