-
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是______;
(2)检验溶液B中是否存在Fe3+的方法是______;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是______ 2CuCl↓+SO42-+2H+高三化学解答题中等难度题查看答案及解析
-
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是________;
(2)检验溶液B中是否存在Fe3+的方法是________;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是________;
(Ⅱ)(1) 常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
氨水物质的量浓度
(mol·L-1)
盐酸物质的量浓度
(mol·L-1)
混合溶液
pH
①
0.1
0.1
pH=5
②
C
0.2
pH=7
③
0.2
0.1
pH>7
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=________mol·L-1;从第②组情况表明,C ________0.2 mol·L-1(选填“>”、“<”或“=”);从第③组情况分析可知,混合溶液中c(NH4+)
________c(NH3·H2O)(选填“>”、“<”或“=”)。
(2)写出以下四组溶液NH4+离子浓度由大到小的顺序________> ________> ________>________(填选项编号)。
A.0.1mol·L-1NH4Cl
B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O
C.0.1mol·L-1NH3·H2O
D.0.1mol·L-1NH4Cl和0.1mol·L-1HCl
高三化学填空题极难题查看答案及解析
-
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
氨水物质的量浓度/(mol·L-1)
盐酸物质的量浓度/(mol·L-1)
混合溶液pH
①
0.1
0.1
pH=5
②
c
0.2
pH=7
③
0.2
0.1
pH>7
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
高三化学填空题极难题查看答案及解析
-
铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜
含杂质
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
溶液B经过________、__________、___________可得到氯化铜晶体;
检验溶液B中是否存在
的方法是_________;
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液
氨水
已知元素在高价态时常表现氧化性,若在酸性
溶液中加入一定量的
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
高三化学实验题中等难度题查看答案及解析
-
氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。
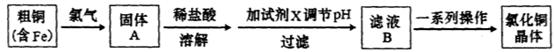
(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
A. NaOH B. NH3.H2O C. CuO D..Cu(OH)2 E. CuSO4
(3)滤液B经一系列操作可得氯化铜晶体,操作的程序依次为_________ 、_________、 过滤、自然干燥。
(4)实验室采用如下图所示装置,可使粗铜与Cl2反应转化为固体A(部分加热仪器和夹持装置已略去)。
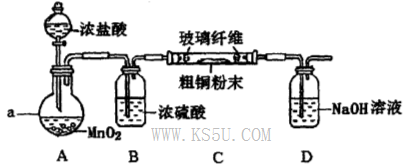
①该装置中仪器a的名称是____,其中发生反应的离子方程式是____________。
②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为是否必要?____________(填“是”或“否”)。
③该装置存在一定的安全隐患,消除该安全隐患的措施是_______________________。
高三化学填空题中等难度题查看答案及解析
-
铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜
含杂质铁
制备氯化铜晶体
的流程如下:

已知常温下,
、
的氢氧化物开始沉淀和沉淀完全时的pH见下表:
金属离子
氢氧化物开始沉淀时的pH
氢氧化物完全沉淀时的pH
请回答下列问题:
溶液I中加入试剂X可以调节溶液pH,从而除去
且不引入杂质。
试剂X可选用下列物质中的______
填代号
。
调节溶液pH时,理论上可选择pH最大范围是______。
由溶液Ⅱ制备
的操作依次为:边滴加浓盐酸边加热浓缩、______
填操作名称
、过滤、洗涤干燥。
室温下,将NaOH溶液逐滴加入到浓度均为
的
和
混合溶液中,先生成的沉淀是______
室温时
,
。
某学习小组用碘量法测定
样品的纯度
杂质不与发生反应
实验如下:
准确称取
样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液。
已知:
移取
待测溶液于锥形瓶中,加几滴指示剂,用c
标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V
。(已知:
)
实验中使用的指示剂名称为______,达到滴定终点时的溶液颜色变化为______。
该样品中
的质量分数为______
用含m、c、V的代数式表示,不用化简
。
高三化学工业流程困难题查看答案及解析
-
(15分)某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有______性的次氯酸,相关反应的化学方程式为____________________________。
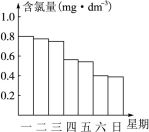
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8:00换水,然后通入氯气消毒,通常游泳池中水的含氯量控制在0.5 mg·L-1至1.0 mg·L-1之间时,效果最好。右图是该小组测定的每天19:00时游泳池中水的含氯量,哪几天使用游泳池不安全?______。
(3)你认为哪几天的天气炎热、阳光强烈______,说出一种理由是
__________________________(必要的方程式和文字)。
(4)在对游泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法______。
A.用湿润的毛巾捂住口鼻跑向低处
B.用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C.用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D.用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型游泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液消毒而非氯气的一项理由__________________;用化学方程式说明工业上如何生产漂白液?________________________________________________________________________。
高三化学其它简单题查看答案及解析
-
铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
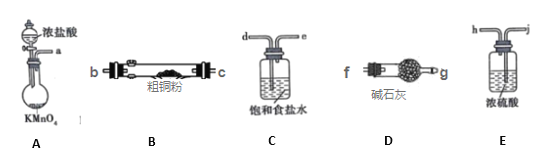
(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液

已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
高三化学实验题中等难度题查看答案及解析
-
铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产.
I.CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
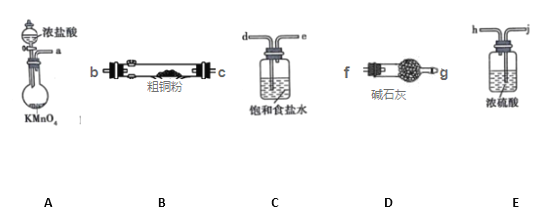
(1)写出装置A中,发生反应的化学反应方程式:_______________________________,装置C的作用是_______________________________
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→_________________________。(每种仪器限使用一次)
(3)上述D装置的作用是____________________
(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入_________,并过滤。
A.Cu B.CuCO3 C.CuO D.NaOH
ⅡCuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:_______________________________ 。
方法二 铜粉还原CuSO4溶液

已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl-
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是_______________,当观察到_________________________________________________________________________________现象,即表明反应已经完全。
(2)②中,加入大量水的作用是______________。(从平衡角度解释)
(3)溶液中氯离子浓度达到一定量时,生成CuCl会部分溶解生成CuCl2-在一定温度下建立两个平衡: Cu Cl(s)
Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)
CuCl2-(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2-]的函数关系曲线(要求至少标出曲线上一个坐标点)
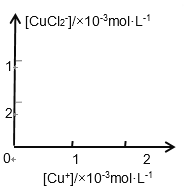 _______________
_______________高三化学综合题中等难度题查看答案及解析
-
(18分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________;X与过量浓硝酸反应后溶液中含有的盐的化学式为________。
(2)某溶液中有Mg2+、Fe2+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.A13+ D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如下:
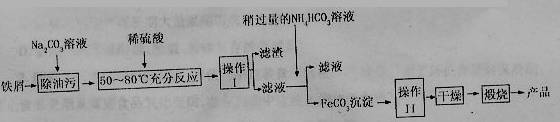
回答下列问题:
①操作I的名称是________,操作II的名称是________;操作III的
方法为________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________;
③请完成生成FeCO3沉淀的离子方程式________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定
(5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是________。
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
③某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
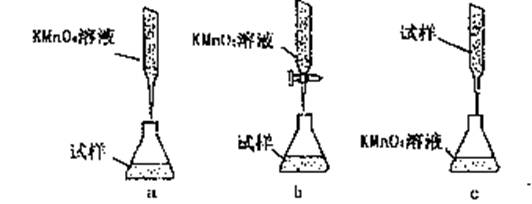
[
高三化学填空题简单题查看答案及解析