-
H2C2O4是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,下列溶液的离子浓度关系式正确的是( )
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2mol•L-1
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
高三化学单选题中等难度题查看答案及解析
-
H2C2O4 是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-4下列溶液的离子浓度关系式正确的是
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2mol/L
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
高三化学单选题中等难度题查看答案及解析
-
H2C2O4 为二元弱酸,Ka1(H2C2O4 ) =5.4×10−2,Ka2(H2C2O4)=5.4×10−5,设H2C2O4 溶液 中 c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用 NaOH 溶液滴定25.00 mL 0.1000 mol∙L−1 H2C2O4 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A. pH = 7 的溶液:c(Na+) =0.1000 mol∙L−1+ c(C2O42−) −c(H2C2O4)
B. c(Na+)=c(总)的溶液:c(Na+)>c(H2C2O4 ) >c(C2O42− ) >c(H+ )
C. 0.1000 mol∙L−1 H2C2O4 溶液:c(H+) =0.1000mol∙L−1 +c(C2O42− )+c(OH−) −c(H2C2O4 )
D. c(Na+)=2c(总)的溶液:c(OH−) −c(H+) = c(H2C2O4) +c(HC2O4−)
高三化学单选题困难题查看答案及解析
-
已知草酸为二元弱酸:
H2C2O4
HC2O4-+H+ Ka1
HC2O4-
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
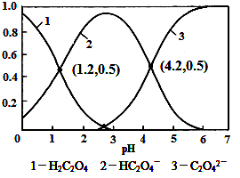
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
高三化学选择题极难题查看答案及解析
-
已知草酸为二元弱酸:
H2C2O4
HC2O4-+H+ Ka1
HC2O4-
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
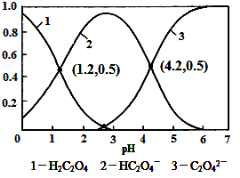
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
高三化学选择题极难题查看答案及解析
-
已知草酸为二元弱酸:
H2C2O4
HC2O4-+H+ Ka1
HC2O4-
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
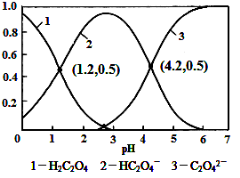
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
高三化学选择题极难题查看答案及解析
-
探究草酸(H2C2O4)的性质,室温下进行以下两组实验:(已知:室温下,H2C2O4的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5)
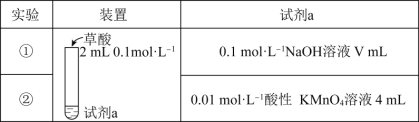
下列有关实验说法正确的是( )
A.若实验①中V=2,则混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若实验①中V=4,则混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.实验②反应的离子方程式为5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若实验②测得KMnO4溶液的褪色时间为40s,则这段时间内的平均反应速率v(KMnO4)=2.5×10-4mol•L-1•s-1
高三化学单选题中等难度题查看答案及解析
-
二元弱酸是分步电离的,25时碳酸和草酸的
如下表:
H2CO3
Ka1=4.3×10-7
H2C2O4
Ka1=5.6×10-2
Ka2=5.6×10-11
Ka2=5.42×10-5
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。
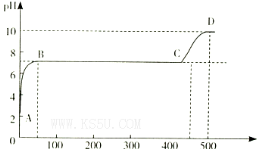
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)=_________ mol/L。
高三化学填空题困难题查看答案及解析
-
二元弱酸是分步电离的,25时碳酸和草酸的
如下表:
H2CO3
Ka1=4.3×10-7
H2C2O4
Ka1=5.6×10-2
Ka2=5.6×10-11
Ka2=5.42×10-5
(l)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示。
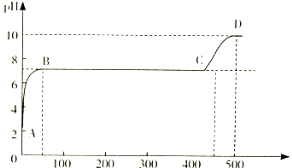
刚开始滴入碳酸钠溶液时发生反应的离子方程式为 ,BC段发生反应的离子方程式为 ,D点时混合溶液中由水电离产生的c(H+)=_________ mol/L。
高三化学填空题困难题查看答案及解析
-
已知草酸(H2C2O4)为二元弱酸,25℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。用NaOH溶液滴定草酸氢钾(KHC2O4)溶液,混合溶液的相对导电能力随加入NaOH体积的变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列有关描述中正确的是
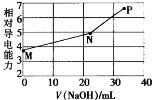
A.M点粒子浓度:c(K+)>c(
)>c(
)>c(H2C2O4)
B.N点时存在:c(Na+)+c(K+)<2c(
)+2c(
)
C.从N点到P点的过程中溶液中一定存在:c(Na+)+c(H2C2O4)>c(
)
D.水的电离程度大小顺序:P>N>M
高三化学多选题困难题查看答案及解析