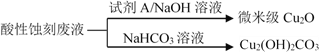-
近年来,我国(PCB)印刷电路板制造业发展迅速,总产值居世界第一。工业上常用CuCl2和盐酸的混合液作为蚀刻液,蚀刻PCB表面的铜箔。
已知:①一定条件下,Cu与Cu2+反应可生成+ 1价铜。
②氯化亚铜(CuCl)难溶于水,可与Cl-形成CuCl32-进入溶液。
Ⅰ.蚀刻过程中将Cu转化为CuCl32-去除。
(1)蚀刻过程的离子方程式有_______、CuCl+2Cl-  CuCl32-。
CuCl32-。
(2)蚀刻液中的盐酸可大大提高蚀刻效率,结合上述反应解释原因:______________。
Ⅱ.蚀刻一段时间后,将蚀刻废液中的CuCl32-转化为Cu2+,即可再生循环利用,常用方法如下:
(1)化学再生:加入H2O2溶液可使蚀刻液再生,该反应的离子方程式是______________。
(2)电解再生(电极不参与反应):按下图装置,使蚀刻液再生并回收金属Cu。

①在______极(填“a”或“b)”)回收得到金属Cu。
②结合电极反应解释阳极区蚀刻液再生的原理:________。
③实际电解过程中,通常在两极上均产生少量气体,则流出液1、流出液2混合后,还需补充试剂________,得到可循环使用的再生液。
④研究表明:其他条件不变,使用无膜电解槽再生时,一段时间后,电极上析出的Cu总量反而会随电解时间的増长而减少。解释Cu的总量减少的原因:________。
-
(12分)近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
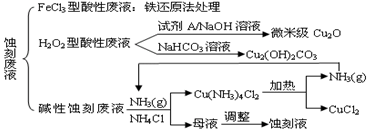
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 、 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 。
⑸ 碱性蚀刻液在蚀刻过程中发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 。
-
(18分)近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
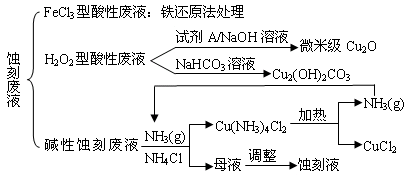
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 ▲ 、 ▲ 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
▲ 。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 ▲ (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 ▲ 。
⑸ 碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 ▲ 。
-
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、碱性的(NH3-NH4Cl)以及传统的(HCl-FeCl3)等3种.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.几种蚀刻废液的常用处理方法如下:
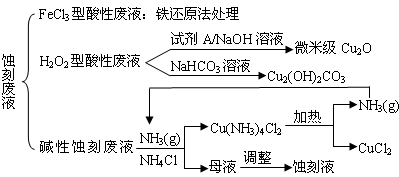
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生.发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有________、________.(用离子方程式表示).
(2)HCl-H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:________.
(3)H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的________(填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
(4)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________.
(5)碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3•H2O+O2=2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是________.
-
电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问 题:
题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为: ,该过程中调节溶液的pH为5,则c(Fe3+)为: mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
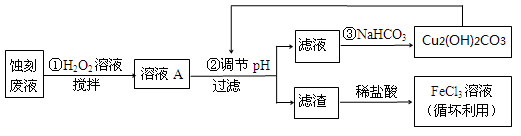
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有: 。
② FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是: 。
③ 步骤①中加入H2O2溶液的目的是: 。
④ 已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是: 。
⑤ 写出步骤②中生成CO2的离子方程式: (已知Cu2(OH)2CO3难溶于水)
-
印刷电路板(简称PCB)是电子产品的重要组成部分,在PCB的加工过程中,常采用碱性蚀刻法,蚀刻后的废液中存在大量的[Cu(NH3)4]C12,如果直接排放不仅造成资源浪费,而且污染环境。下图是碱性蚀刻制PCB,并利用蚀刻废液制碱式碳酸铜(Cu2(OH)2CO3)的工艺流程。
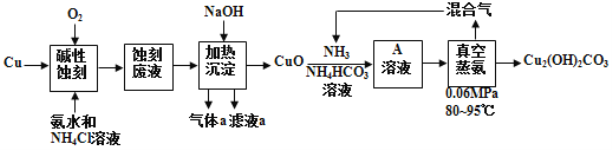
(1)碱性蚀刻时发生反应的化学方程式为_____________________________________。
(2)滤液a的溶质主要是__________。(化学式)
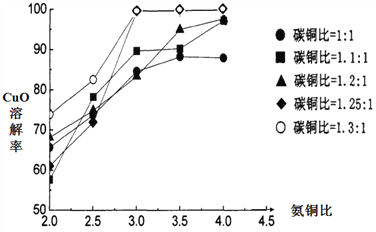
(3)不同的氨铜比和碳铜比条件下溶解CuO得A溶液,实验结果如下图。该反应的最佳实验条件为_______________________________。(氨铜比指n(NH3)∶n(CuO),碳铜比指n(NH4HCO3)∶n(CuO) )
(4)A溶液主要含[Cu(NH3)n]2+,对溶液中析出的无水碳酸盐进行分析后,测得元素质量分数为N:17.5%,Cu:39.7%,则此蓝色晶体的化学式是____________。
(5)写出真空蒸氨反应的化学方程式__________________________________________。
(6)蒸氨时,如果选择在常压80℃条件下进行,即使反应24小时,也仅有少量氨蒸出,且不Cu2(OH)2CO3沉淀析出。原因为______________________________________。
(7)除流程中标出的循环使用的物质外,还可循环使用的物质有__________。
(8)已知某次实验从0.4L 含Cu元素140g/L的蚀刻废液获得碱式碳酸铜82.5g,则Cu元素回收率为_____________(结果保留至1%)。
-
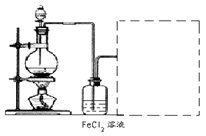
(18分)电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
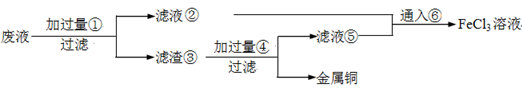
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:________。
(2)检验废腐蚀液中含有Fe3+的实验操作是________
(3)“过滤”用到的玻璃仪器有:普通漏斗、________。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
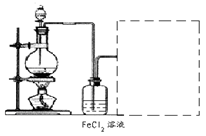
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
-
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:。
(2)检验废腐蚀液中含有Fe3+的实验操作是________
(3)“过滤”用到的玻璃仪器有:普通漏斗、________。
(4)废液中加入过量①后,发生反应的离子方程式:________
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
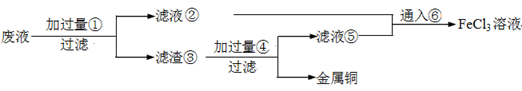
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
制备Cl2的化学方程式为:________
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
-
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用.按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
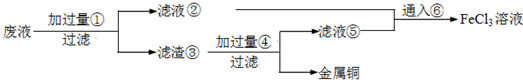
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:______.
(2)检验废腐蚀液中含有Fe3+的实验操作是______.
(3)“过滤”用到的玻璃仪器有:普通漏斗、______.
(4)废液中加入过量①后,发生反应的离子方程式:______.
(5)上述流程中取废液200mL,其中含CuCl2 1.5mol•L-1、FeCl2 3.0mol•L-1、FeCl3 1.0mol•L-1,若要将铜全部回收,需加入Fe粉的质量应不少于______g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于______mol.
-
工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为________。
②该蚀刻液中加入一定量盐酸的目的为________,同时提高蚀刻速率。
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+  3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+  Fe2++Cu,还有________、________。(用离子方程式表示)。
Fe2++Cu,还有________、________。(用离子方程式表示)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:
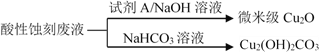
①蚀刻铜板主要反应的离子方程式为________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a. Fe粉 b. 葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________。
(3)应用碱性蚀刻液(NH3•H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为________。
(4)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO•),进一步反应实现蚀刻液再生,结合化学用语解释CuCl2蚀刻液再生的原理________。
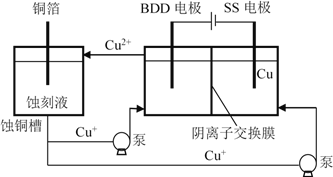
CuCl32-。