-
苯甲酸为白色片状晶体,熔点122.4℃,苯甲酸是常用的食品防腐剂。苯甲酸在水中的溶解度为:
| 25℃ | 50℃ | 100℃ |
| 0.344g | 0.849g | 6.8g |
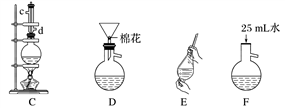
实验室有混有杂质(杂质为:泥沙和少量可溶性杂质)的粗苯甲酸,用下列实验方法(重结晶)可以分离得到纯净的苯甲酸晶体,实验步骤为:
A、将粗苯甲酸1g加到100mL的烧杯中,再加入50mL蒸馏水。
B、____________________________________,全溶后再加入少量蒸馏水。
C、使用短颈漏斗(下端玻璃管短的漏斗)趁热将溶液过滤到另一100mL烧杯中。
D、将滤液静置,使其缓慢冷却结晶,滤出晶体。
回答下列问题:
(1)上述步骤中有两次过滤操作,过滤用到的玻璃仪器有_________________________。步骤D中,需要洗涤晶体,洗涤步骤为:向过滤器中注入__________(填“冷水”或“热水”)至浸没沉淀,使洗涤液自然流下,重复操作2~3次。
(2)步骤B横线上的实验操作为_______________________________________________。
(3)步骤B中“全溶后再加入少量蒸馏水”和步骤C中“短颈漏斗”的作用是一样的,其目的是_____________________________________________________________。
(4)温度越低,苯甲酸的溶解度越小,但结晶时的温度并不是越低越好,请分析原因________。
(5)重结晶也适用于两种可溶性固体的分离,如NaCl和KNO3的分离。已知溶解度曲线如图:
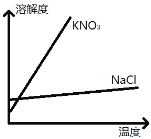
KNO3固体中混有少量NaCl杂质,提纯KNO3的方法为:__________→__________,降温结晶→___________→洗涤。
-
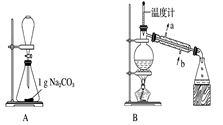
苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
| 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是___________________,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时。
(2)B装置的冷凝管的主要作用是_____________,可否换为球形冷凝管(填“可”或“否”)。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为_______________(填装置字母代号)。
(4)A中Na2CO3的作用是____________________;D装置的作用是___________________
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出
-
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度.
-
苯甲酸钠是常用的食品防腐剂,其结构简式为C6H5COONa。下列有关苯甲酸钠的说法正确的是( )
A.苯甲酸钠的溶液呈中性
B.苯甲酸钠溶液呈酸性
C.苯甲酸钠溶液通入二氧化碳可以生成苯甲酸
D.苯甲酸钠可以通过苯甲酸和碳酸氢钠反应来合成
-
苯甲酸(C6H5COOH)和山梨酸(CH3CH=CHCH=CHCOOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是
A. 金属钠 B. 氢氧化钠 C. 溴水 D. 乙醇
-
苯甲酸(C6H5COOH)和山梨酸(CH3CH==CHCH==CH—COOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是
A.金属钠 B.氢氧化钠
C.溴水 D.乙醇
-
苯甲酸(C6H5COOH)和山梨酸(CH3CH==CHCH==CH—COOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是
A.金属钠 B.氢氧化钠
C.溴水 D.乙醇
-
苯甲酸(C6H5COOH)和山梨酸(CH3-CH=CH-CH=CH-COOH)都是常用的食品防腐剂. 下列物质中只能与其中一种酸发生反应的是( )
A.金属钠
B.氢氧化钠
C.溴水
D.乙醇
-
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料, 可用作止痛剂、退热剂、防腐剂和染料中间体,乙酰苯胺的制备原理为: +CH3COOH
+CH3COOH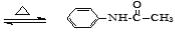 +H2O,有关物质的性质如下表:
+H2O,有关物质的性质如下表:
| 名称 | 式量 | 性状 | 密度/g·cm-3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,易氧化 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
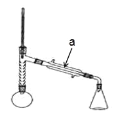
实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉 0.1 g,安装仪器, 加入沸石,调节加热温度,使分馏柱顶温度控制在 105℃ 左右,反应约 60~80 min,反应 生成的水及少量醋酸被蒸出。
步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛 100 mL 冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步 骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)仪器 a 的名称____________________;
(2)步骤 1 加热可用______________(填“水浴”或“油浴”);
(3)制备过程中加入锌粒的作用:___________________;
(4)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因_______________________;
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:粗产品溶于沸水中配 成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→________________→过 滤→洗涤→干燥;
(6)该实验最终得到纯品 10.8g,则乙酰苯胺的产率是______________;
(7)如果重结晶过程中,加入活性炭过多,会造成产率下降,其可能原因为_________________。
-
(9分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为
无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有________(选填序号)。
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子中没有支链,其结构简式是________
(3)由B制取A的化学方程式是________。



 +H2O,有关物质的性质如下表:
+H2O,有关物质的性质如下表: