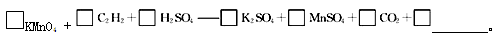-
(15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;
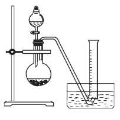
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式
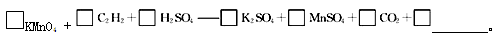
若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol • L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
-
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。

实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽 、、________、________。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用________ mL的量筒。
(3)生成气体体积是 ________________ mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是________ 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□________。若该实验生成的 C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液________mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
-
草酸是一种二元弱酸,可用作还原剂、络合剂、掩蔽剂、沉淀剂。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。
回答下列问题:
(1)甲组的同学利用电石(主要成分CaC2,少量CaS及Ca3P2等)并用下图装置制取C2H2[反应原理为:CaC2+2H2O Ca(OH)2+C2H2(g) △H<0,反应剧烈]:
Ca(OH)2+C2H2(g) △H<0,反应剧烈]:
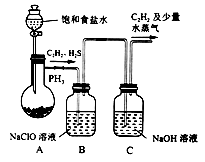
① 装置A用饱和食盐水代替水并缓慢滴入烧瓶中,其目的是__________。
② 装置B中,NaClO将H2S、PH3氧化为硫酸及磷酸,本身还原为NaCl,其中H2S被氧化的离子方程式为________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化乙炔制取H2C2O4·2H2O。制备装置如下:
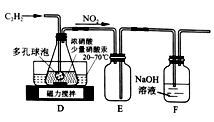
①装置D多孔球泡的作用是_________;装置E的作用是________。
②D中生成H2C2O4的化学方程式为_______。
③从装置D得到产品,还需经过浓缩结晶、________(填操作名称)洗涤及干燥。
(3)丙组设计了测定乙组产品在H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:精确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,在加入少量稀硫酸,然后用cmol/L酸性KMnO4标准溶液进入滴定,滴至溶液显微红色;共消耗标准溶液VmL。
①滴定时,KMnO4标准溶液盛放在__________滴定管中(填“酸式”或“碱式”)。
②滴定时KMnO4被还原Mn2+,其反应的离子方程式为_____,滴定过程中发现褪色速率先慢后逐渐加快,其主要原因是__________。
③产品中H2C2O4·2H2O的质量分数为_________(列出含m、c、v的表达式)。
-
草酸是一种二元弱酸,可用作还原剂、络合剂、掩蔽剂、沉淀剂。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。
回答下列问题:
(1)甲组的同学利用电石(主要成分CaC2,少量CaS及Ca3P2等)并用下图装置制取C2H2[反应原理为:CaC2+2H2O Ca(OH)2+C2H2(g) △H<0,反应剧烈]:
Ca(OH)2+C2H2(g) △H<0,反应剧烈]:
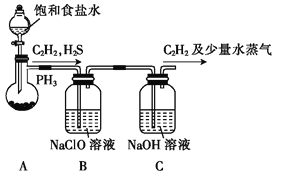
① 装置A用饱和食盐水代替水并缓慢滴入烧瓶中,其目的是__________。
② 装置B中,NaClO将H2S、PH3氧化为硫酸及磷酸,本身还原为NaCl,其中H2S被氧化的离子方程式为________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化乙炔制取H2C2O4·2H2O。制备装置如下:
①装置D多孔球泡的作用是_________;装置E的作用是________。
②D中生成H2C2O4的化学方程式为_______。
③从装置D得到产品,还需经过浓缩结晶、________(填操作名称)洗涤及干燥。
(3)丙组设计了测定乙组产品在H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:精确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,在加入少量稀硫酸,然后用cmol/L酸性KMnO4标准溶液进入滴定,滴至溶液显微红色;共消耗标准溶液VmL。
①滴定时,KMnO4标准溶液盛放在__________滴定管中(填“酸式”或“碱式”)。
②滴定时KMnO4被还原Mn2+,其反应的离子方程式为_____,滴定过程中发现褪色速率先慢后逐渐加快,其主要原因是__________。
③产品中H2C2O4·2H2O的质量分数为_________(列出含m、c、v的表达式)。
-
草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
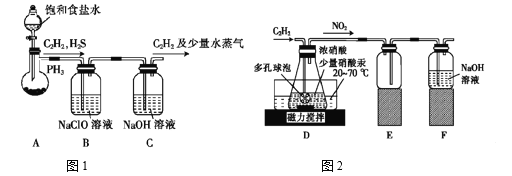
①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是__________(写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为______。该过程中,可能产生新的杂质气体Cl2,其原因是: _____________(用离子方程式回答)。
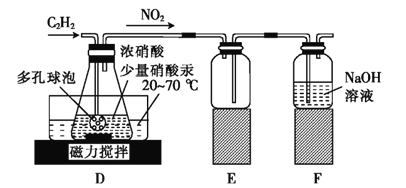
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为____________________________。
③从装置D中得到产品,还需经过_____________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是______________________。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是_______________。
③产品中H2C2O4·2H2O的质量分数为_______________(列出含 m、c、V 的表达式)。
-
草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4•2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用图1装置制取C2H2。
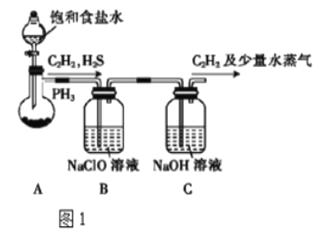
①装置A中用饱和食盐水代替水的目的是__。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为__。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4•2H2O.制备装置如图2所示:
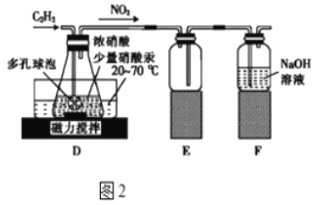
①装置D中多孔球泡的作用是__。
②装置D中生成H2C2O4的化学方程式为__。
③从装置D中得到产品,还需经过__(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4•2H2O的质量分数实验。他们的实验步骤如下:准确称取mg产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用cmol•L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液VmL。
①滴定终点的现象是__。
②产品中H2C2O4•2H2O的质量分数为___(列出含m、c、V的表达式)。
-
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度(固体电石--CaC2与水可快速反应生成难溶于水的C2H2,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑).请填写下列空白:
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.
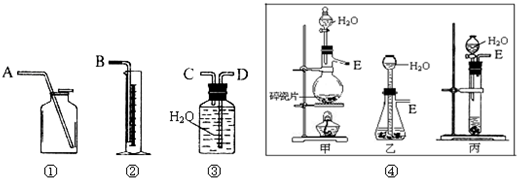
(1)制取C2H2最好选④中的______.所选用装置的连接顺序是(填各接口A~E的顺序):______.
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______.
Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g |
锥形瓶十水十试样 | 第1次 | 196.4 |
| 第2次 | 196.2 |
| 第3次 | 196.1 |
| 第4次 | 196.0 |
| 第5次 | 196.0 |
(3)计算CaC2的质量分数时,必需用的数据是______.不必作第6次读数的原因是______.
Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:

(4)操作Ⅱ的名称是______.
(5)要测定CaC2试样的纯度,还需知道的数据是______.
(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果______(填“偏大”、“偏小”或“不变”).
-
(题文)乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。
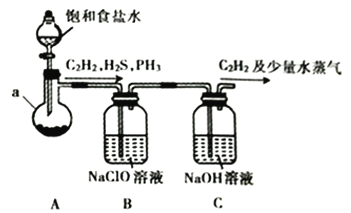
①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知: 用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。
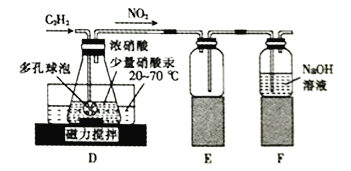
①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
-
乙炔(C2H2) 是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石( 主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同) 制备C2H2。
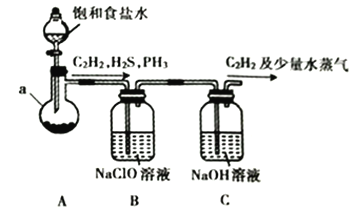
①仪器a的名称为__________________________。
②CaC2 的 电 子式 为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知: 用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。
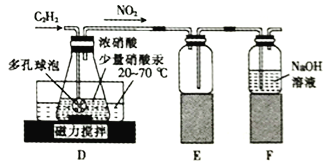
①装置E 的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________ (填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O 晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/L KMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________ (用含m、c、V的式子表示)。
-
乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为___________________________。
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3 kJ/mol
C2H2(g)+2.5O2(g)===2CO2(g)+H2O(l) ΔH2=-1299.6 kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH3=-571.6 kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的ΔH=________kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
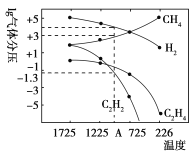
①T1℃时,向1 L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)  C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的ΔH_____0(填“>”或“<”),CH4的平衡转化率为________。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01 mol/(L·s)的平均速率增多,经t s后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>” 或“<”)T2,t=________s;
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的ΔH_____0(填“>”或“<”),CH4的平衡转化率为________。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01 mol/(L·s)的平均速率增多,经t s后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>” 或“<”)T2,t=________s;
②列式计算反应2CH4(g)  C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=__________________(用平衡分压代替平衡浓度计算,lg0.05=-1.3);
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=__________________(用平衡分压代替平衡浓度计算,lg0.05=-1.3);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有__________________。