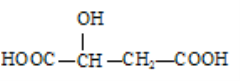-
根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素价电子排布式_____________________。
(2)外围电子排布式为3d54s2的原子,其原子结构示意图为____________,其最高正价为________;其在元素周期表中的位置为:___________________。
(3)下列分子中是否有手性原子:_________(填“有”或“无”,若有请在图中碳原子下方用“*”标出)
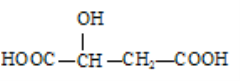
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO3________HClO4; H3PO4________H3PO3。
-
根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________,电子排布式_____________________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),形成的单质为______晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____
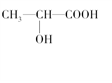
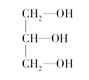
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; HClO3________HClO4; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______杂化,VSEPR构型为__________,分子的立体构型为__________________。
②BF3分子中,中心原子的杂化方式为________杂化,分子的立体构型为____________。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________.
-
(8分)根据要求完成下列问题:
(1)某元素原子共有6个价电子,其中一个价电子位于第四能层s轨道,试回答:
该元素的原子结构示意图______________,价电子排布的轨道表示式________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),最高正化合价为______价。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___________ 、_____________、_________。
-
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2) 、
、 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出 原子的核外电子排布式:______。
原子的核外电子排布式:______。
| 电离能/ | 
| 
| 
| 
|
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
-
A、B、C、D、E五种元素中,A原子第三能层轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为______,中心原子的VSEPR构型为______.
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是______.
(3)D的元素符号是______,它的价电子排布式为______,在形成化合物时它的最高化合价为______.
(4)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键______.
-
W、X、Y、Z 四种元素原子序数依次减小。已知W的原子序数为29;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能数据如下表;Z原子价电子排布式为nsnnpn。请回答下列问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
(1)W基态原子的电子排布式为________。
(2)电负性:X________Y(填“>”、“=”或“<”)。
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物高,原因是________。
(4)Z2X4中,Z原子采用________杂化,每个分子中含有________个σ键,________个π键。
(5)已知W2+能与氨分子形成配离子[W(NH3)4]2+,该配离子中存在的化学键有________。(填标号)
A.金属键 B.离子键 C.共价键 D.配位键
-
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe |
| 电离能 ( kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 |
| I3 | 3248 | 2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
-
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)在元素周期表中M位于_____区,基态M原子的价层电子排布图为_____,第四能层s轨道上电了数目和M元素相同的元素还有_____(填元素符号)。
(2)元素Y基态原子的核外电子排布式为_______,其同周期元素中,第一电离能最大的是____(写元素符号)。元素Y的含氧酸中,酸性最强的是_____(写化学式),该酸根离子的立体构型为_______。
(3)Z与元素Y同主族,在该族中原子序数最小,Z的气态氢化物的稳定性大于Y的气态氢化物的稳定性,原因是__________,Z的气态氢化物的沸点大于Y的气态氢化物的沸点,原因是_____。
-
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)在元素周期表中M位于_____区,基态M原子的价层电子排布图为_____,第四能层s轨道上电了数目和M元素相同的元素还有_____(填元素符号)。
(2)元素Y基态原子的核外电子排布式为_______,其同周期元素中,第一电离能最大的是____(写元素符号)。元素Y的含氧酸中,酸性最强的是_____(写化学式),该酸根离子的立体构型为_______。
(3)Z与元素Y同主族,在该族中原子序数最小,Z的气态氢化物的稳定性大于Y的气态氢化物的稳定性,原因是__________,Z的气态氢化物的沸点大于Y的气态氢化物的沸点,原因是_____。
-
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。