-
从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O ________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________, 被氧化的N原子的物质的量为__________。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________、_________、_________。
高三化学综合题困难题查看答案及解析
-
对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题.
(1)关于反应物之间的定量关系的研究:已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol•L-1的FeBr2溶液中通入0.001mol Cl2,该反应的离子方程式为:______
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=______.
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)2H2(g)+O2(g)△H=+484kJ•mol-1不同时段产生O2的量见下表:
则前20min的反应速率 v(H2O)=______;达平衡时,至少需要吸收的光能为______kJ.时间/min 20 40 60 80 n(O2)/mol 0.0010 0.0016 0.0020 0.0020 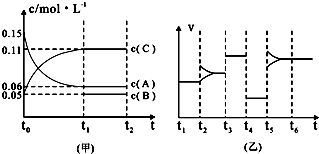
③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示.附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同.已知,t3-t4阶段为使用催化剂[已知t-t1阶段c(B)未画出].请回答:
I:t4-t5阶段改变的条件为______,
II:B的起始物质的量为______.高三化学解答题中等难度题查看答案及解析
-
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为________
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=________
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
2 H2O(g)
2 H2 (g) + O2(g) △H=+484kJ· mol-1,不同时段产生O2的量见下表:
时间/min
20
40
60
80
n(O2)/mol
0.0010
0.0016
0.0020
0.0020
则前20min的反应速率v(H2O)=________;达到平衡时,至少需要吸收的光能为________kJ。
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:

Ⅰ:t4~t5阶段改变的条件是________t5~t6阶段改变的条件是________
Ⅱ:B的起始浓度为________,该反应方程式为________
高三化学化学题中等难度题查看答案及解析
-
分类思想以及用分类思想研究一类物质的通性和特殊性是学习化学的一种重要思维方式和手段。以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
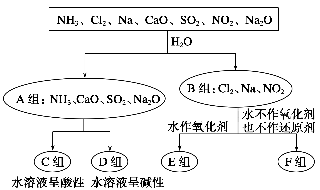
(1)上述第一级分类标准(分成A、B组的依据)是____________________。
(2)F组中物质除了Cl2外还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:
______________________________________________________________。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,用离子方程式说明理由:_______________________________________________________。
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3为分散质的红褐色胶体
①该红褐色胶体中Z(OH)3粒子的直径大小范围是______________。
②FeCl3溶液滴入沸水可得到Fe(OH)3红褐色胶体的反应的离子方程式是____________________________。
高三化学填空题中等难度题查看答案及解析
-
(17分)在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:

①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):

资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
高三化学填空题极难题查看答案及解析
-
从化学角度分析,下列叙述不正确的是:
A、化学是在分子原子水平上认识物质,所以通过化学手段可以识别、改造和创造分子
B、化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志
C、绿色化学是指以绿色植物为原料来源的现代新型化学工业
D、化学反应中的能量变化常用焓变(△H)来表示,△H=H(反应产物)-H(反应物)
高三化学选择题中等难度题查看答案及解析
-
从化学角度分析,下列叙述不正确的是( )
A.化学是在分子原子水平上认识物质,所以通过化学手段可以识别、改造和创造分子
B.化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志
C.绿色化学是指以绿色植物为原料来源的现代新型化学工业
D.化学反应中的能量变化常用焓变(△H)来表示,△H=H(反应产物)-H(反应物)高三化学选择题中等难度题查看答案及解析
-
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为________。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
起始浓度( mol/L)
C(NH3)
C(O2)
C(NO)
C(H2O)
甲
1
2
0
0
乙
4
8
0
0
丙
0.2
x
y
z
①恒温恒容下,平衡时NH3的转化率甲________乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=________,y=________,z= ________.
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_________a2。
A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是________。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:________。反应过程中,氧化剂和还原剂物质的量之比为________。
(2)若反应中生成0.2mol HNO3,转移的电子数目为________。
高三化学填空题极难题查看答案及解析
-
从化学角度分析,下列叙述不正确的是
A.化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志
B.铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等
C.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的净化
D.高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障。但低空的臭氧是污染气体,会给人体造成伤害
高三化学选择题中等难度题查看答案及解析
-
(16分)硫代硫酸钠(Na2S2O3)是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”。易溶于水,不溶于乙醇。在棉织物漂白、定量分析中有广泛应用。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【样品制备】实验室中常用亚硫酸钠和硫磺制备Na2S2O3·5H2O。写出反应的化学方程式________________________________;
反应液经脱色、过滤、浓缩结晶、过滤、洗涤、干燥即得产品。所得晶体用乙醇洗涤的目的是________________________;
【提出问题】Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①:;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【性质探究】基于上述猜想②、③,设计实验方案。
实验操作
实验现象或
预期实验现象
现象解释(用
离子方程式表示)
猜想②
________________________,将试纸与标准比色卡对照
溶液pH=8
向pH=2的硫酸中
滴加Na2S2O3溶液
________
2S2O32- +2H+ ══ S↓+ SO2 ↑+ H2O
猜想③
向新制氯水中滴加少量Na2S2O3溶液
氯水颜色变浅
________
【实验结论】
Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由:________。
(2)请重新设计一个实验方案,证明Na2S2O3具有还原性。你的实验方案是:________。
高三化学实验题困难题查看答案及解析