-
(题文)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2===CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:A.乙醇、B.________、C.NaOH溶液。

(1)B中盛装的试剂是________________(填化学式)。
(2)A中加入乙醇的目的是___________________。
(二)探究草酸的酸性
将0.01 mol草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是________________________ (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
Ⅰ.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸,反应原理:
 MnO
MnO +
+ H2C2O4+
H2C2O4+ ____===
____=== Mn2++
Mn2++ CO2↑+
CO2↑+ H2O
H2O
(1)配平上述离子方程式。____________________
(2)滴定时KMnO4溶液应盛装于______________(填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
| 实验 组别 | c(H2C2O4) (mol·L-1) | V(H2C2O4) (mL) | c(KMnO4) (mol·L-1) | V(KMnO4) (mL) | c(H2SO4) (mol·L-1) | 褪色所 需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.002 5 | 4 | 0.12 | 6′55″ | (a) |
| 2 | 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ |
| 3 | 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ |
| 4 | 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ |
| 5 | 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ |
| 6 | 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
请回答:
(1)实验目的(a)是___________________________________________。
(2)若要探究催化剂对该反应速率的影响,应选择MnSO4而不选MnCl2作为催化剂,其原因是_____________________________________________________________。
-
(15分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

①B中盛装的试剂 (填化学式);
②A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO +□H2C2O4+□ =□Mn2++□CO2↑+□H2O
+□H2C2O4+□ =□Mn2++□CO2↑+□H2O
①配平上述离子方程式;
②滴定时KMnO4溶液应盛装于 (填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 |
| 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积 (mL) |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| | | | | |
(1)探究温度对化学反应速率影响的实验编号是 (填编号,下同),探究反应物浓度对化学反应速率影响的实验编号是 。
(2)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。

请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: _____。
-
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
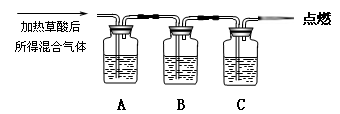
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4 + = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6'55'' | (a) |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5'17'' |
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3'20'' |
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9'05'' |
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11'33'' |
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
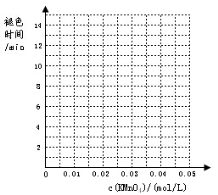
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
-
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4 + = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6'55'' | (a) |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5'17'' | | |
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3'20'' | | |
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9'05'' | | |
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11'33'' | | |
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14'20'' | | |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;

(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
-
某研究性学习小组的同学通过查阅资料得到如下信息:草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,受热脱水、升华,易溶于水,170℃以上分解可得到CO、CO2、H2O,H2C2O4难溶于水。他们欲利用如下装置验证上述产物(加热仪器、夹持仪器省略)。
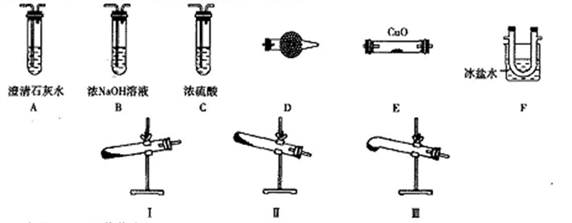
(1)加热草酸晶体使其分解的装置是________(从I、II、III中选取),验证其分解产物的装置依次是______→A→尾气处理装置(用装置字母作答,装置可重复使用)。
(2)D中试剂是_________,证明有CO生成的现象是_______。
(3)实验中有两处需要加热,加热的顺序是_________,写出一种处理尾气的方法:_____________。
(4)若上述实验均产生了预期的现象,写出草酸分解的化学方程式:_________________。
(5)设计一种方案证明草酸是弱酸_________。
-
草酸 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
| 物质 | 性质 |
| 
|  易溶于水和乙醇,微溶于乙醚,不溶于苯和氯仿。 易溶于水和乙醇,微溶于乙醚,不溶于苯和氯仿。
 熔点为 熔点为 , , 时开始升华, 时开始升华, 时开始分解。 时开始分解。
 有毒,具有腐蚀性,二元弱酸。 有毒,具有腐蚀性,二元弱酸。
 草酸与浓硫酸混合加热产生 草酸与浓硫酸混合加热产生 、CO和 、CO和 。 。
 草酸钙和草酸氢钙均为白色不溶物。 草酸钙和草酸氢钙均为白色不溶物。
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有 和
和 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略

(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为 装置可重复使用
装置可重复使用 ________
________ ________
________ ________
________ ________
________ 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________ 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F” 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为

 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸 ,无水甲醇
,无水甲醇 ,苯
,苯 ,浓硫酸
,浓硫酸 ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。

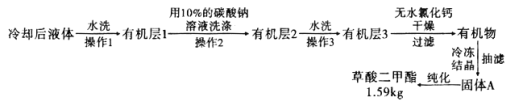
(6) 提纯过程中用
提纯过程中用 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
 流程中纯化的方法为________________。
流程中纯化的方法为________________。
 产率为____________
产率为____________ 精确到
精确到 。
。
-
草酸 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
| 物质 | 性质 |
| 
|  易溶于水和乙醇,微溶于乙醚,不溶于苯和氯仿。 易溶于水和乙醇,微溶于乙醚,不溶于苯和氯仿。
 熔点为 熔点为 , , 时开始升华, 时开始升华, 时开始分解。 时开始分解。
 有毒,具有腐蚀性,二元弱酸。 有毒,具有腐蚀性,二元弱酸。
 草酸与浓硫酸混合加热产生 草酸与浓硫酸混合加热产生 、CO和 、CO和 。 。
 草酸钙和草酸氢钙均为白色不溶物。 草酸钙和草酸氢钙均为白色不溶物。
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有 和
和 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略
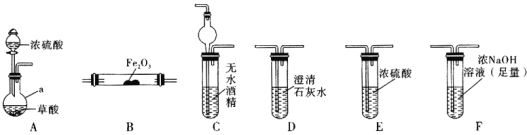
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为 装置可重复使用
装置可重复使用 ________
________ ________
________ ________
________ ________
________ 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________ 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F” 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为

 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸 ,无水甲醇
,无水甲醇 ,苯
,苯 ,浓硫酸
,浓硫酸 ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
(6) 提纯过程中用
提纯过程中用 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
 流程中纯化的方法为________________。
流程中纯化的方法为________________。
 产率为____________
产率为____________ 精确到
精确到 。
。
-
草酸是草本植物常具有的成分。查阅相关资料得到草酸晶体(H2C2O4·3H2O)及其盐的性质如下表。

(1)草酸晶体(H2C2O4·3H2O)175℃以上会发生分解生成三种氧化物,某实验小组欲通过实验证明这三种氧化物。
①该小组选用装置丙作为分解装置,不选用甲装置的原因是________________。丙装置相对于乙装置的优点是____________。实验前检验该装置气密性的操作方法是_________。
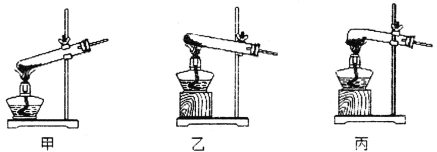
②从下图选用合适的装置,验证分解产生的气体,装置的连接顺序是____________。(用装置编号表示,某些装置可以重复使用,也可以装不同的试剂)

③B装置的作用是________________________。
(2)某实验小组称取4.0g粗草酸晶体配成100mL溶液,采用0.1mol·L-1酸性高锰酸钾溶液滴定该草酸溶液,测定该草酸晶体的纯度。
①配制草酸溶液需要用到的主要玻璃仪器有_______________。
②本实验达到滴定终点的标志是______________________。
③将所配草酸分为四等份,实验测得每份平均消耗酸性高锰酸钾溶液20mL。计算该粗草酸中含草酸晶体的质量为_______g(保留两位有效数字)。
-
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
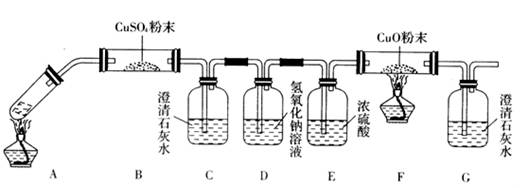
据此,乙二酸分解的产物为___________________________。上述装置中,D的作用是_____
__________________________________________。装置F中发生反应的化学方程式为:
___________________________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________
________________________________________________________________。
-
已知乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______.
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
______ MnO4-+______ H2C2O4+______ H+=______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
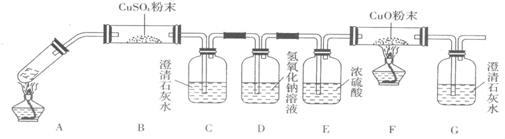
据此,乙二酸分解的产物为______.上述装置中,D的作用是______. 装置F中发生反应的化学方程式为:______ Cu+CO2

MnO
+
H2C2O4+
____===
Mn2++
CO2↑+
H2O















