-
氮可以形成多种离子和分子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+中共价键的类型除极性键,非极性键外再写出一种__________。
(2)下列关于NH2-的说法合理的是____________________(填字母)。
A.H-N-H夹角109.5° B. H-N-H夹角180° C. H-N-H夹角大约105°
D.中心原子的杂化轨道为四面体形 E. 该离子为V形 F.易与H+结合
(3)写出N3-的等电子体且是中性分子的化学式___________________(一种)。
(4)N2H4名称是肼,也叫联氨,通常为无色油状发烟液体,有吸湿性,有氨的臭味。可作为火箭的燃料。其沸点比氨气高的主要原因是________________________。
利用含N的铜萃取剂M可通过如下反应实现铜离子的富集:
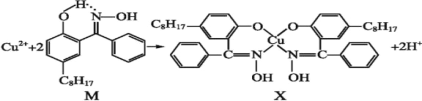
(5)X难溶于水、易溶于有机溶剂,X中配位原子是______。
(6)M中氮原子以_______杂化轨道与氧原子形成σ键。
(7)M与W(如图)是同分异构体,则在水中溶解度较大的物质是___(填字母M或W)。
(8)常用 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为 。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。

-
氮可以形成多种离子,如N3--,NH2--,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+在碱性溶液中反应的离子方程式_________。
(2)NH2-的电子式为__________。
(3)N3-有 ______个电子。
(4)写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式________。
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型_______________。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是_________。
-
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:_____________________________________。
(2)NH2-的电子式为__________________________,NH2-的构型为____________。
(3)写出一种与N3-是等电子体的微粒化学式___________。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N N键。则“N5”分子碎片所带电荷是_______。
N键。则“N5”分子碎片所带电荷是_______。
-
氮可以形成多种离子,如N3﹣,NH2﹣,N3﹣,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似
于NH4+,因此有类似于 NH4+的性质.
(1)写出N2H62+在碱性溶液中反应的离子方程式 .
(2)NH2﹣的电子式为 .
(3)N3﹣有 个电子.
(4)写出二种由多个原子组成的含有与N3﹣电子数相同的物质的化学式 .
(5)等电子数的微粒往往具有相似的结构,试预测N3﹣的构型 .
(6)据报道,美国科学家卡尔•克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片所带电荷是 .
-
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式______________________。
⑵NH2-的电子式为_______________。
⑶N3-有________个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_____、____。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型___________________。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是___________。
-
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式 。
⑵NH2-的电子式为 。
⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 、 。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
-
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式_________;
⑵NH2-的电子式为_________;
⑶N3-有_______个电子;
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_________;
⑸等电子数的微粒往往具有相似的结构,试预测N3-的构型_________。
-
(9分)氮元素可形成多种离子,如N3—、N3—、NH2—、NH4+、N2H5+、N2H62+等。
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为_______
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,说明N2中的________键比________键稳定(填“σ”或“π”)。
(3)液态氨可电离出NH2-。NH2-的电子式为________。
(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)________;Na3N也为离子化合物,则Na3N与水反应的化学方程式为________,反应类型为________。
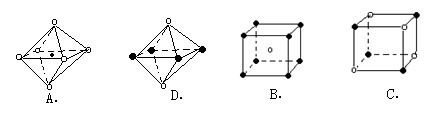
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3—形成的晶体结构如图所示。与同一个N3—相连的X+ 有________个。X原子的基态电子排布式为_____________

(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构。下图是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是_______
-
氮元素可形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等.
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为______
(2)N≡N的键能为942kJ•mol-1,N-N单键的键能为247kJ•mol-1,说明N2中的______键比______键稳定(填“σ”或“π”).
(3)液态氨可电离出NH2-.NH2-的电子式为______.
(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)______;Na3N也为离子化合物,则Na3N与水反应的化学方程式为______,反应类型为______.
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有______个.X原子的基态电子排布式为______
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是______.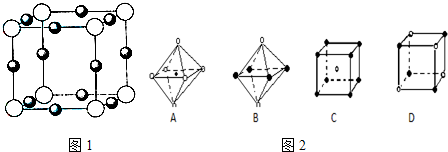
-
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有________个运动状态不同的未成对电子。
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是_______。
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有____________;不能作为配位体的有____________。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因 是________。
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子的杂化类型是______。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6)肼能与硫酸反应生成N2H6SO4。N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力


表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。



