-
“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:___________________。
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4 (g) N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是_________________
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c. N2H4 和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
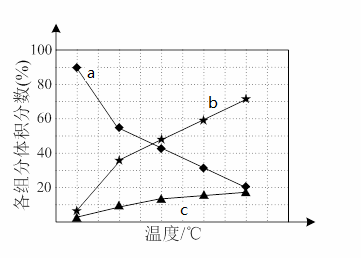
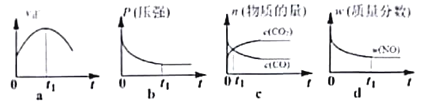
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示,其中曲线b表示的是________(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有___________________(任写一种)。
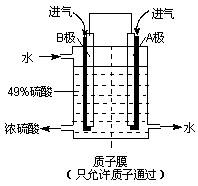
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
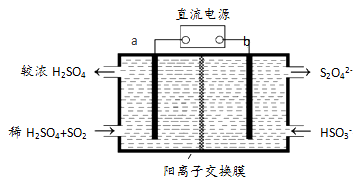
a极为 _________(填“阴”“阳”) b极的电极反应式为__________________。简述该装置能吸收SO2的原理:_____________________。
-
“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
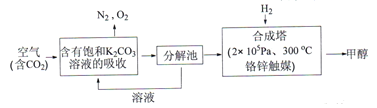
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
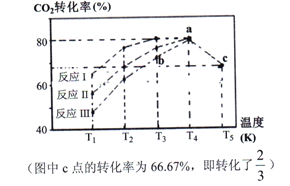
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g)  2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。
(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)
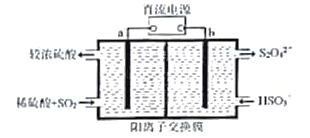
a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
-
“一带路”为中国化工企业开辟了新的国际市场,能源环保是基础。在能源领域科学家提出构想——富集空气中的CO2,并使之与H2反应生成可再生能源甲醇.流程如下:

(1)在合成塔中,若有4400gCO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式________________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2在不同催化剂作用下发生反应I、反应II、反应III,相同时间内CO2的转化率随温度变化如图1所示:

①催化效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)______v(逆) (填“>”、“=”或“<”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
(3)选取合适的催化剂发生上述反应,测得甲醇的产率与反应温度、压强的关系如图2。
④分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为________;将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将_______(填“增大”、“减小”或“不变”)。
⑤200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量______g(用含a、V的代数式表示)。
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)==PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将_____(填“增大”、“减小”或“不变”)。
-
煤是重要的能源和化工原料,直接燃烧既浪费资源又污染环境.最近,某企业利用“煤粉加压汽化制备合成气新技术”,让煤变成合成气(一氧化碳及氢气总含量≥90%),把煤“吃干榨尽”.下列有关说法正确的是( )
①煤粉加压汽化制备合成气过程涉及化学变化和物理变化 ②煤粉加压汽化制备合成气过程涉及化学变化但没有物理变化 ③该技术实现了煤的清洁利用 ④该技术实现了煤的高效利用.
A.①②③
B.①②④
C.①③④
D.②③④
-
煤是重要的能源和化工原料,直接燃烧既浪费资源又污染环境。最近,某企业利用“煤粉加压气化制备合成气新技术”,让煤变成合成气(一氧化碳及氢气总含量≥90%),把煤“吃干榨尽”。下列有关说法正确的是( )
①煤粉加压气化制备合成气过程涉及化学变化和物理变化 ②煤粉加压气化制备合成气过程涉及化学变化但没有物理变化 ③该技术实现了煤的清洁利用 ④该技术实现了煤的高效利用
A.①②③ B.①②④ C.①③④ D.②③④
-
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K= ,它所对应的化学反应为:________________。
,它所对应的化学反应为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3 kJ/mol
CO2(g)+H2(g) △H=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:________________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO2、N2O4等,对反应N2O4(g) 2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
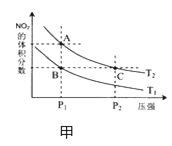
A. A、C 两点的反应速率:A>C
B. A、C 两点气体的颜色:A 深,C浅
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态 B 到状态 A,可以用加热的方法
E. A、C 两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3,25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加 n L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(NH3·H2O的电离平衡常数取Kb=2×10﹣5 mol/L)。
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触。
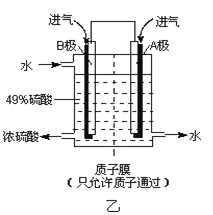
①溶液中H+的移动方向由________极到________极;(用 A、B 表示)
②B电极的电极反应式为____________。
-
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=__________ ,
CH3OCH3(g)+CO2(g)的ΔH=__________ ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应 N2O4(g) 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
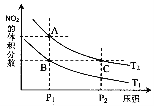
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3 。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
-
“一带一路(One Belt And One Road)”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会的 共同理想和美好追求。下列贸易的商品中,其主要成分属于无机物的是
A. 中国丝绸 B. 埃及长绒棉 C. 捷克水晶 D. 乌克兰葵花籽油
-
“一带一路(One Belt And One Road)”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易的商品中,其主要成分不属于有机物的是
A.中国丝绸 B.埃及长绒棉 C.乌克兰葵花籽油 D.捷克水晶
-
共建“一带一路”符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易商品中,主要成分属于无机物的是
| A. 中国丝绸 | B.捷克水晶 | C.埃及长绒棉 | D.乌克兰葵花籽油 |
| 
| 
| 
| 
|
A.A B.B C.C D.D
N2(g)+4NH3(g)















