-
以铝土矿(主要成分为 Al2O3)为原料,用真空氯化亚铝(AlCl)歧化法,无需进行分离提纯,直接制备金属 Al。其反应过程主要由两步组成,如下图:
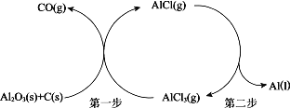
(1)已知:
Al2O3 (s) + 3C (s) 2Al (l) + 3CO (g) ΔH=+1346 kJ·mol-1
2Al (l) + 3CO (g) ΔH=+1346 kJ·mol-1
3AlCl (g) AlCl3 (g) + 2Al (l) ΔH=−140 kJ·mol-1
AlCl3 (g) + 2Al (l) ΔH=−140 kJ·mol-1
① 第一步反应的热化学方程式是_____。
② 第二步 AlCl 分解反应的化学平衡常数 K 随温度升高而_____(填“增大”、“不变”或“减小”)。
(2)第一步是可逆反应,选择在接近真空条件下进行,其原因是_____。
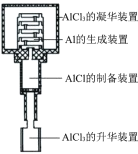
(3)第二步反应制备的 Al 中含有少量 C,可能的原因是_____(不考虑未反应的 C,写出 1 种即可)。
(4)图为真空 AlCl 歧化法制备 Al 的实验装置示意图,控制AlCl3 的凝华装置、Al 的生成装置和 AlCl 的制备装置的温度分别为 T1、T2、T3,其由高到低的顺序是_____。
(5)制备 Al 的整个过程中可循环利用的物质是_____。
-
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=______kJ•mol-1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______.
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(aq)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+ O2(g)═H2O(l)△H=-285.84kJ•mol-1
O2(g)═H2O(l)△H=-285.84kJ•mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
-
真空碳热还原—氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s) 3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g) 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应Al2O3(s) +3C(s) 2Al(l)+3CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
2Al(l)+3CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
-
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。
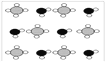
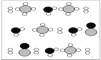
一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
-
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原一氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol−1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol−1
①反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________kJ·mol−1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为:_____________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是____________________________。
②在6.0mol·L−1 HCl溶液中,混合物Y能完全释放出H2。1mol Mg17Al12完全吸氢后得到的混合物Y与上述足量盐酸完全反应,释放出H2的物质的量为__________________。
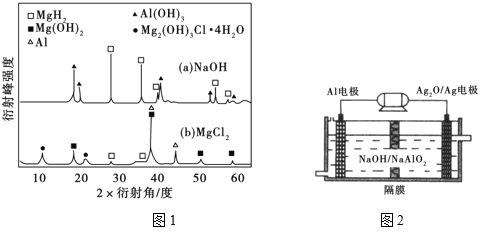
③在0.5mol·L−1 NaOH和1.0mol·L−1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图1所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是_______________ (填化学式)。
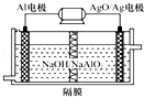
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图2所示。该电池负极反应式为______________________________________。
-
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol﹣1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H= kJ•mol﹣1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为 .
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2═17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 .
②在6.0mol•L﹣1HCl溶液中,混合物Y能完全释放出H2.1mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 .
③在0.5 mol•L﹣1NaOH和1.0 mol•L﹣1MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质X﹣射线衍射谱图如下图所示(X﹣射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式).
(3)铝电池性能优越,Al﹣AgO电池可用作水下动力电源,其原理如右下图(图2)所示.该电池反应的化学方程式为: .
-
工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:
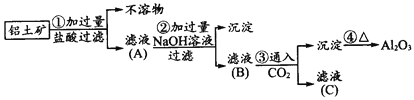
(1)请写出下列反应的化学方程式:②_________________、 _________________。③____________。
(2)若①步没有过滤操作而直接进入步骤②,对后面的操作会有什么影响?________________________。
-
真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①Al2O3(s)+3C(s)=2Al(s)+3CO(g) △H1=1344.1kJ·mol-1
②2AlCl3(g)=2Al(s)+3Cl2(g) △H2=1169.2kJ·mol-1
③Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g) △H3=QkJ·mol-1
下列有关说法正确的是( )
A.反应①中化学能转化为热能
B.反应②中若生成液态铝则反应热应大于△H2
C.反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量
D.该生产工艺中能循环利用的物质只有AlCl3
-
(13分)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
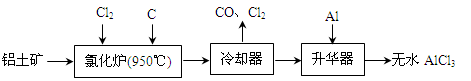
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 ,在标准状况下,吸收112L Cl2需要 molNa2SO3。
(3)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AlCl3,实现这一步的操作方法是在 (填试剂)中加热。
(4)工业上铝土矿经提纯后可冶炼铝,写出在950-970℃和冰晶石作用下进行电解制铝反应的化学方程式 。
-
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: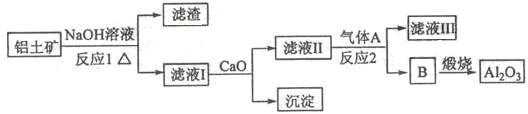
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: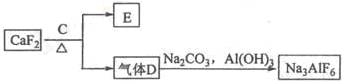
回答下列问题:
(1)写出反应1的化学方程式___________________________ ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为_______________ ;
(3)E可作为建筑材料,化合物C是_____ ,写出由D制备冰晶石的化学方程式 ____________;
(4)电解制铝的化学方程式是 _____________________________________,以石墨为电极,阳极产生的混合气体的成分是 _________________。

2Al (l) + 3CO (g) ΔH=+1346 kJ·mol-1
AlCl3 (g) + 2Al (l) ΔH=−140 kJ·mol-1









